化学式
| この項目には、一部のコンピュータや閲覧ソフトで表示できない文字が含まれています。 |
化学式(かがくしき、英: chemical formula)とは、化学物質を元素の構成で表現する表記法である。分子からなる物質を表す化学式を分子式(ぶんししき、英: molecular formula)、イオン物質を表す化学式をイオン式(イオンしき、英: ionic formula)と呼ぶことがある。化学式と呼ぶべき場面においても、分子式と言い回される場合は多い。
化学式が利用される場面としては、物質の属性情報としてそれに関連付けて利用される場合と、化学反応式の一部として物質を表すために利用される場合とがある。
目次
1 種類
2 化学式の構成
2.1 同位体の扱い
3 組成式
3.1 実験式
4 構造式
4.1 特殊な構造式
4.1.1 電子式
4.1.2 立体表示と投影法
5 脚注
6 参考文献
7 関連項目
種類
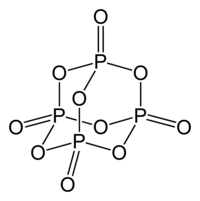
五酸化二リン(十酸化四リン)
化学式は大きく分けて物質の元素組成を示す組成式と、分子構造を表示する構造式とに分類される。前者はもっぱら化学量論に基づく化学方程式の中などで使われて量的関係を示すことが多く、後者は分子構造を図示したり、反応機構を説明する化学反応式などで反応に特有な構造やそれに関連した性質を示す場合に利用することが多い。
組成式と構造式とは必ずしも合致しない。たとえばリン酸の無水物である五酸化二リン(右図)は、組成式的には P2O5 であるが、構造式からは分子の最小単位がP4O10であることがわかる。
特に有機化合物は異性体が多いために、構造式や示性式(後述)で物質を識別する機会が多く、無機化合物では組成式で十分物質の識別が可能であることが多い。
以下に主な化学式の種類を示す。
- 組成式
- 分子式
- 示性式
- 構造式
- 電子式
化学式の構成
組成式も構造式も物質を構成する元素の種別は元素記号を使って表現される。また同一原子の個数を示すために元素記号の右下付き添え字をつけて表現する。
- 五酸化二リン
- P2O5(組成式)
- エタノール
- CH3CH2OH(構造式)
またポリマーなどで反復の個数をワイルドカード的に示す場合に n、m などの英小文字が右下付き添え字として利用される場合もある。
- ポリアセタール
- CH3CO[OCH2CH2]nOCOCH3
ラジカルあるいはイオンを表現する必要がある場合は、右上付き添え字で示す。ラジカルの場合は '・' を添え字とし、さらにイオンである場合は電荷に応じて '+' または '-' の符号を添え字とする。2価以上のイオンの場合は、正負を表す符号の前(左側)に価数を示す数字を添え字とする。
- スーパーオキシドアニオン
- O2−
化学式の部分構造を示すために丸括弧 ( ) や角括弧 [ ] が使用される場合もある。閉じ括弧に右下付き添え字が存在する場合は括弧で括られた部分構造がその添え字の数字の回数だけ反復することを意味する。ワイルドカード的に示すために n、m などの英小文字が使用される場合もある。
- ポリアセタール
- CH3CO[O(CH2)2]nOCOCH3
括弧で括られた部分構造がラジカルあるいはイオンである場合は上記と同様な規則で閉じ括弧の右上付き添え字として付与する。
- ヘキサシアノ鉄 (II) 酸イオン
- [FeII(CN)6]4-
物質が一定比率の複数の要素で構成される場合は、各要素の化学式を·(ドット。日本語の約物である中黒「・」とは異なる記号[要検証])で連結して1つの分子式として表す。特にイオン式の場合で、陽・陰イオンの構成比が1:1の場合は·が省略される場合もある。各構成要素の比率を示す場合は、それぞれの化学式の左側に係数をつける。係数は数値で示す場合と、ワイルドカード的に示すために n、m などの英小文字が使用される場合とが存在する。
- 硫酸銅 (II) 5水和物
- CuSO4·5H2O
- 塩化ナトリウム
- Na+Cl−
- 塩化コバルトn水和物
- CoCl2·nH2O
係数は比を既約してそれぞれに整数をつけるスタイルと、主要素の量を1とし、残りの要素の比を分数で示すスタイルとがある。いずれのスタイルであっても、係数が1の場合は省略される場合が多い。
- 硫酸カドミウム·水 (3/8)
- 3CdSO4·8H2O
- 半水セッコウ
- CaSO4·12{displaystyle {frac {1}{2}}}
H2O
同位体の扱い
通常、元素は天然組成比の同位体混合物を意味している。特定の同位体が含まれていることを明示する場合は、元素記号の表記方法に準じて元素記号の左上付き添え字に原子量を表記する。また、重水素(デューテリウム)、三重水素(トリチウム)の場合は D と T とがそれぞれ使用される場合がほとんどである。
18O-水- H218O
- クロロホルム-d
- CDCl3
組成式
物質の元素組成を示す化学式を組成式(そせいしき、英: compositional formula, nominal composition)と呼ぶ。一般式(いっぱんしき、英: general formula)とよばれる場合もある。組成式は各元素毎にその比がまとめられるために、水素原子の省略や括弧を使った反復表現は使用されない。ただ, 任意の金属元素を示す M やハロゲン元素を示すX など、ワイルドカード的な利用例が見られる程度である。
- 五酸化二リン
- P2O5(組成式)
- ハロゲン化銅 (II)
- CuX2
実験式
実験的に求められた組成式を実験式(じっけんしき、英: empirical formula)と呼ぶ。組成式の場合、科学的知見に基づいた物質の構成から理論的に導かれる組成であるため、部分分子式の係数や元素記号の添え字として使用する原子数は整数とするのが普通である。一方、実験式の場合は定量的な測定結果に基づいて決定されるため、係数や添え字は必ずしも整数にはならない。
- セッコウ
- CaSO4·1.1H2O
構造式
物質の構造を示すための化学式を構造式とよぶ。通常は平面上に構造のトポロジー的な関係だけを維持して表現されるので、構造式は実際の構造を写実的に写したものではない。通常、構造式は二次元に展開された図表として表現されるが、特に結合を表す線分を使わずに、分岐部分を基として括弧で括って一連の文字列で表した構造式は示性式と呼ばれる。
構造式を示すには次に示す2つの方法がある。
- 個々の原子の間を化学結合を表す、一重線(単結合)、二重線(二重結合)あるいは三重線(三重結合)で連結して分子構造を表す方法。
特性基や基を連結して分子構造を表す方法。
これらの一方ないしは両方を使って構造式は表される。言い換えると示性式は後者の方法のみを使用し、基を組み立てて作成される。
「破線」は紙面の奥、「くさび形」は紙面の手前に原子が伸びていることを表しており、これで疑似的に立体構造を表現する。
- アラニン
- H2NCH(CH3)C(O)OH(示性式)
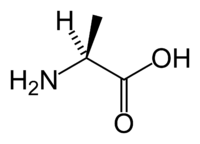 (構造式)
(構造式)
組成式とは異なり、構造式では特徴のある構造を強調する目的で種々の省略形が用いられる。特に示性式では下に示すような基を表す略号が汎用される[1]。
| 部分構造 | 略号 |
|---|---|
| CH3 | Me |
| CH3CH2 | Et |
| CH3CH2CH2 | Pr |
| (CH3)2CH | iPr |
| CH3CH2CH2 CH2 | Bu |
| (CH3)3C | tBu |
| C(=O)H | CHO |
| C(=O)OH | COOH, CO2H |
| C(=O)OCH2CH3 | COOEt, CO2Et |
| C(=O)NH2 | CONH2 |
示性式以外の構造式は骨格となる炭化水素部分の水素原子や炭素原子は省略形で作図される場合が多い。たとえば末端以外の炭素原子に置換している水素原子そのほとんどは結合も含めて作図されないことが多い。また、骨格の炭素原子は元素記号の表示が省略されて作図されないことが多く、言い換えると線分の頂点が炭素原子をあらわす場合が多い。しかし作図上紛らわしい場合は省略せずに表記すべきであり、省略されなかった水素原子は指示水素と呼ばれることがある。あるいは上述の基を表す略号の C や H は省略できない。
同一の物質(1-ブテン)を様々な化学式で書き表した例。
特殊な構造式
電子式
原子同士の結合に関与する電子(価電子)対をコロン「:」で表現したもの。
ルイス(1916年)が考案した[2]ため、ルイス構造式(Lewis structure)ともいう。
- 窒素N2
- :N:::N:
立体表示と投影法
もともと構造式は透視図法のような立体を平面に射影した図表ではなく、トポロジー的な情報、すなわち個々の原子と連結した原子との相対的な位置関係以外は図表に表現され得ない。したがって、種々の立体表示方法と投影法が考案されている。つぎに立体表示方法と投影法の例を示す。
- ニューマン投影法
CIP則によるRS表記法
脚注
^ 関連:宇都宮大学工学部超分子化学研究室(刊日不明)『有機基礎化学I 資料』2010年8月17日閲覧。
^ 論拠:Dickerson, Richard E; Gray, Harry B; Haight, Gilbert P.(1979年)「Chapter 11 Lewis Structures and the VSEPR Method」『Chemical principles』(第3版)The Benjamin/Cummings(カリフォルニア州メンロー・パーク)、ISBN 9780805323986、400頁目、2010年8月17日閲覧。
参考文献
ルイス, ギルバート・ニュートン(1916年4月)「The atom and the molecule」『Journal of the American Chemical Society』38巻4号762〜85頁、doi:10.1021/ja02261a002
関連項目
- 官能基略語一覧
- 化学
- 化学式量
- 立体化学
- 価標
- 構造式エディタ
- CAS登録番号
- IUPAC命名法

 (構造式)
(構造式)