胃癌
| 胃癌 | |
|---|---|
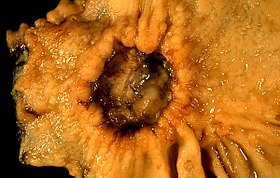 胃癌の疑いがあるとして切除された胃潰瘍の標本 | |
| 分類および外部参照情報 | |
| 診療科・ 学術分野 | 腫瘍学 |
ICD-10 | C16 |
ICD-9-CM | 151 |
| OMIM | 137215 |
| DiseasesDB | 12445 |
| MedlinePlus | 00022 |
| eMedicine | med/845 |
| MeSH | D013274 |
| GeneReviews |
|
胃癌(いがん、英:Stomach cancer または gastric cancer、独:Magenkrebs)は、胃に生じる悪性腫瘍・癌の総称。初期の症状には、胸やけ、上腹部の痛み、吐き気、食欲不振などがある[1]。進行すると、減量、瞳孔黄変、嘔吐、嚥下困難、血便などがある[1]。がんは胃以外にも広がりえ、とりわけ肝臓、肺、骨、腹膜、リンパ節などがある[2]。
最も多い原因はヘリコバクター・ピロリ菌への感染であり、60%以上を占める[3][4][5]。特定種のピロリ菌は、他のピロリ菌よりも高リスクである[3]。喫煙、食事習慣(たとえば漬物や肥満)などもリスク要因である[3][6]。症例の10%は家族も同じ疾患であり、1-3%は遺伝性びまん性胃がんによる[3]。胃がんのほとんどは消化器癌腫である[3]。複数のサブタイプが存在する[3]。悪性リンパ腫や間葉も形成されうる[3]。多くの胃がんは数年かけて形成される[3]。診断は一般的に胃カメラによる生検による[1]。さらに他への転移を調べるために、医療イメージングがなされる[1]。日本と韓国は発病率が高いため胃がんスクリーニングが行われている[3]。
世界的には、胃がんはがんの中で5番目に多く、また死因では3番目に位置づけられ、死因の7-9%を占めている[7]。2012年には95万人が罹患し、72.3万人が死亡した[7]。1930年代以前では、西欧諸国のほとんどを含む世界の多くの地域において、癌による死亡の最も一般的な原因であった[8][9][10]。しかし時代を経るにつれ、世界の多くでは死亡率が減少している[3]。 その理由は、食物を新鮮に保つ方法として冷蔵が開発されたため、漬物による塩分の摂取量が減少したたためと考えられている[11]。胃がんの多発地域は、東アジアと東ヨーロッパである[3]。男性は、女性の2倍発症する[3]。
目次
1 定義
2 疫学
3 原因
3.1 感染症
3.2 塩分・塩蔵品
3.3 喫煙・飲酒
3.4 コレステロール
3.5 β-カロテン
3.6 緑茶
3.7 胃癌検診
3.8 日本人の伝統的食生活
4 病理
5 症状
6 検査
6.1 画像検査
6.2 検体検査
7 病期(ステージ)
7.1 病期分類
8 治療
8.1 内視鏡治療
8.2 手術治療
8.3 化学療法
8.4 放射線治療
8.5 生物学的療法(免疫療法)
9 予後
10 出典
11 関連項目
12 参考文献
13 外部リンク
定義
広義の「胃癌」には以下の種類がある。
- 胃粘膜上皮から発生した癌腫:狭義の胃癌(本稿で主に記述)
- 上皮以外の組織から発生した悪性腫瘍:GIST・胃悪性リンパ腫など
疫学

2004年における10万人毎の胃がんによる死亡者数(年齢標準化済み)[12]
データなし
3.5以下
3.5-8
8-12.5
12.5-17
17-21.5
21.5-26
26-30.5
30.5-35
35-40
40-45
45-50
50以上
胃癌は中国、日本、韓国などアジアや南米に患者が多く、アメリカ合衆国をはじめ他の諸国ではそれほど顕著ではない。
2003年の日本における死者数は49,535人(男32,142人、女17,393人)で、男性では肺癌に次いで第2位、女性では大腸癌に次いで第2位であった(厚生労働省 人口動態統計より)。かつて日本では男女とも胃癌が第1位であったが、死者数は年々減少している。
日本では、国立がん研究センターがん予防・検診研究センター予防研究グループにおいて、多目的コホート研究(JPHC Study (Japan Public Health Center-based prospective Study))結果が発表されている[13]。
原因
感染症
胃癌の発生過程でヘリコバクター・ピロリ菌(Helicobacter pylori)による「慢性萎縮性胃炎」・「鳥肌胃炎」[14]の関与が示唆されている。ヘリコバクター・ピロリ菌の陽性者では、陰性者と比較して胃癌の発生のリスクは5倍となる。さらに、胃の萎縮の程度が進むと胃癌のリスクも上がり、ヘリコバクター・ピロリ菌感染陽性でかつ、萎縮性胃炎ありのグループでは、陰性で萎縮なしのグループと比較して胃癌の発生リスクは10倍となっている[15]。メタ解析によると、アジアでの無症状の成人を対象としたヘリコバクター・ピロリの除菌は、胃癌発症率および胃癌死亡率を有意に低下させた[16]。しかし、除菌時に既に胃粘膜に病変を生じている場合、除菌が成功しても癌病変(粘膜下浸潤がん)生じる事もある[17]。なお、この病変は内視鏡的存在診断は困難と指摘されている[17]。
塩分・塩蔵品

漬物を取りすぎない
2003年、世界保健機関(WHO)と国連食糧農業機関(FAO)による「食事、栄養と生活習慣病の予防[18]」(Diet, Nutrition and the Prevention of Chronic Diseases) では、食塩の摂取は1日5 g以下(ナトリウム2 g以下)とされ、塩や塩蔵の食品は胃癌のリスクが上がることが起こりうるとしている。
厚生労働省による研究では、塩分濃度の高い食事を日常的に摂取する人たちは、そうでない人たちに比べて胃癌となるリスクが高いことが統計的に示されている[19]。食塩の多い食事で、男性の胃癌リスクが上がる。いくら、塩辛、練りうに、漬物などをよく食べる人で胃癌が多い[20]。食塩(塩化ナトリウム)そのものに胃がんの原因が存在するかは研究によって「関連性が認められる」とするものと「関連性が見いだせない」とするものが存在するが[21]、動物実験においては発がん性物質の発がん(イニシエーション)を食塩が促進(プロモーション)する効果が認められている[22]。前述のピロリ菌と高塩分が重なることによりさらに発がん性物質の発がんが促進される。
喫煙・飲酒
たばこを吸う人は吸わない人に比べて2倍 胃癌になりやすい。お酒を飲むと2倍から3倍 胃噴門部の胃癌になりやすい[23]。
アルコール代謝活性関連遺伝子(AHH1B, ADH1C, ALDH2)との相関を調べたところ、ADH1C、ALDH2の代謝活性が低い遺伝子型で大量飲酒(週あたり150g以上で、日本酒1合相当以上を連日の計算)した場合に、胃癌になりやすい[24]。- アルコール摂取時に、L-システインを同時に摂取することにより、胃内のアセトアルデヒド濃度を下げ、胃癌リスクの低減が図られることが報告された[25]。
コレステロール
総コレステロール低値は、男性の胃癌リスクと関係する[26]。
β-カロテン
男性では、血中β-カロテン濃度が高いと胃癌リスクが低いが、女性では関連が見られない[27]。
緑茶
緑茶をよく飲むと女性の胃癌リスクが下がる[28]。喫煙状態によって、緑茶ポリフェノールと胃癌の関係が変わる。緑茶に胃癌予防効果があるとしても、たばこを吸っている場合には効果は得られない可能性が高い[29]。
胃癌検診
胃癌検診を受けている人では、胃癌による死亡率が低い[30]。
日本人の伝統的食生活
日本人の伝統的な食生活(漬物、いくら・とびこ・数の子・からすみといった塩蔵魚卵、塩辛、魚介類、味噌汁、米を多くとる一方、パン、バター、チーズはあまりとらない)で、胃癌のリスクが高くなる[31]。野菜・果物は少量の摂取で胃癌の発生率を下げる[32]。
病理
組織型としては、ほとんどが腺癌(胃小窩や胃腺に分化する円柱上皮幹細胞から生ずる)であり、まれにガストリン等の内分泌細胞から生ずる内分泌細胞癌(=高悪性度カルチノイド)が発症する。
病理学的には以下に分類される。
一般型
乳頭腺癌(pap:papillary adenocarcinoma)
管状腺癌(tub:tubular adenocarcinoma)
高分化型(tub1:well differentiated type)
中分化型(tub2:moderately differentiated type)
低分化腺癌(por:poorly differentiated adenocarcinoma)
充実型(por1:solid type)
非充実型(por2:non-solid type)
印環細胞癌(sig:signet ring cell carcinoma)
粘液癌(muc:mucinous adenocarcinoma)
特殊型
腺扁平上皮癌(adenosquamous carcinoma)
扁平上皮癌(squamous cell carcinoma)
カルチノイド腫瘍(carcinoid tumor)
印環細胞癌と低分化型は、4型の進展となることが多く、胃が硬くなる「硬癌」の状態となることが珍しくない。一般に「scirrhous(スキルス)胃癌」として早期発見が困難で予後が悪い胃癌の代名詞として知られる。胃切除例の組織分類の検討では、tub1が45.7%と最も多く、低分化型(por1/por2)と印環細胞癌(sig)は合わせると約30%を占めた[33]。
筑波大学・東京医科歯科大学の病理学教授を勤めた中村恭一名誉教授は、「胃癌の三角」という概念を提唱している。すなわち、発生部位(場)・肉眼型・組織型には互いに相関がある。胃底腺領域から発生する癌の95%以上は未分化癌であることなどは、この「胃癌の三角」の臨床診断の一説としている[34]。また歴史的に、胃癌の他覚的発見にちなんで、転移・浸潤先の病変に名称が付けられており、卵巣への直接浸潤として「クルーケンベルグ(Krukenberg)腫瘍」、ダグラス窩(直腸子宮窩)に転移したものは「シュニッツラー(Schnitzler)転移」、左鎖骨窩リンパ節転移は「ウィルヒョウ(Virchow)転移」と呼ばれている。
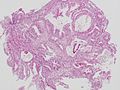
高分化型管状腺癌(tub1)。

中分化型管状腺癌(tub2)。
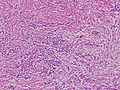
低分化型腺癌(por2)。
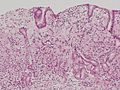
印環細胞癌(sig)。

リンパ球浸潤癌。
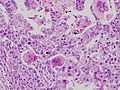
胎児消化管上皮類似癌。
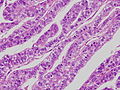
胎児消化管上皮類似癌。左と同症例の別の部位。
写真説明の組織型分類は胃癌取り扱い規約第14版による分類である。
症状
自覚症状による胃癌の早期発見は難しい。ほとんどの場合、早期癌の段階では無症状であり、癌が進行してからでないとはっきりとした自覚症状が出てこないことが多いからである。胃癌は進行してくると次のような症状が出てくる。
- 自覚症状
腹痛・上腹部不快感・吐気・嘔吐・胸焼け・食後の腹部膨満感・食欲減退など
- 理学的症状
- 急な体重減少・腹水貯留・黒色便・吐血・貧血
- 急な体重減少・腹水貯留・黒色便・吐血・貧血
検査
胃癌か否かを決定するのは原則として胃から摂取した細胞の病理検査である。
画像検査
@media all and (max-width:720px){.mw-parser-output .tmulti>.thumbinner{width:100%!important;max-width:none!important}.mw-parser-output .tmulti .tsingle{float:none!important;max-width:none!important;width:100%!important;text-align:center}}


他に発見・診断を目的として以下の検査が行われている。
- 上部消化管造影検査
- いわゆる「バリウム検査」「胃透視」である。内視鏡検査に先んじて、日本で開発・研究された検査であり、現在でもその功績から、多くの癌検診として広く行われている。内視鏡と比較して安全かつ医師でなくても施行できるため、集団検診で用いられる。内視鏡で診断しにくいスキルス胃癌の発見に有効なことがある。また、術前検査として正確な位置診断を行うために有用である。
- 上部消化管内視鏡
- 現在において最も確実な検査方法。病変部の細胞を採取して診断できるため確実度が増す検査であるが、造影検査よりも費用高価・身体負担が多いため、集団検診には向いていない。2013年改訂の厚生労働省指針でも、バリウムを飲むX線検査が従来通り公費検診で推奨され、内視鏡は推奨されてこなかったが[35]、2013年2月21日にピロリ菌の除菌が、その適応を慢性胃炎の段階まで拡大した上で保険適用とされ、要件に上部胃内視鏡検査が盛り込まれた結果、早期の胃がんの発見に結びついたことから[36]、2016年4月より胃内視鏡が追加されている[37]。多くの医療機関・人間ドックで施行されている。
- 胃潰瘍と胃癌の鑑別
- 形態(円滑 vs 不整)
- 大きさ(3cmを超える潰瘍はまれ)
- 陥凹底の性状(凹凸・不整 vs 平滑)
- 潰瘍辺縁の性状(不整 vs 整、蚕食像など)
- 潰瘍周辺の皺襞先端の性状(ヒダの細まり方のなだらかさ、断崖様の途絶など)
- 周囲隆起の性状(浮腫状 vs 顆粒・結節)
- 病変周囲粘膜の性状(発赤・褪色・陥凹などの有無)
- 病変の場(胃底腺領域 vs 幽門腺領域)[38]
- 胃潰瘍と胃癌の鑑別
CT・MRI
- 巨大胃癌でない限り、一般にこれらでの胃癌の診断は困難である。リンパ節、肝などへの転移浸潤の評価、粘膜下腫瘍(SMT)の診断に施行される。

胃体部にみられた早期胃癌内視鏡像(高分化型腺癌)

左と同じ症例(高分化型腺癌)のインジゴカルミン染色内視鏡像
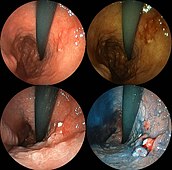
印環細胞を伴う低分化型腺癌の内視鏡像。通常内視鏡像に加え強調画像と色素内視鏡像。左上:通常内視鏡像、右上:通常+FICE、左下:酢酸染色、右下:AIM染色

0-IIa, tub1 の早期胃癌。左列は通常光。右列はFICE。一列目は通常。二列目は酢酸染色。三列目はAIM染色。
検体検査
- ABC検査
ヘリコバクターピロリ感染は胃粘膜の萎縮を引き起こし、胃の発癌要因となるため、感染陽性であれば除菌療法が望ましいとされている。ペプシンの前駆体であるペプシノゲン(PG)の測定を行うことで胃癌高リスク群を類別するという方法で、検診スクリーニングでの有用性が期待されている。PGIは胃底腺の主細胞・副細胞より分泌され、PGⅡは胃底腺以外より分泌されるが、いずれも胃の慢性萎縮性変化で低値となり、分化型腺癌の発生リスクを類別し、高リスク群に対し内視鏡検査へのサーベイランスを計るというもの。- 腫瘍マーカー
- 進行してくるとCEA、CA19-9等の上昇が見られる。転移等が出てくる場合に高値が認められる。
病期(ステージ)
胃癌の進行度は、以下に分類し、生存率がほぼ等しくなるようにグループ分けしたのが病期(Stage)であり、数字が大きくなるほど進行した癌であることを表す。国際的にはUICC(International Union Against Cancer)のTNM分類が用いられるが、日本では胃癌取扱い規約による病期分類が広く使用されている。
画像検査による、臨床診断による病期診断が行われ、手術加療を行う場合には、手術結果によって最終的な病期診断(Final Stage)が確定される。
病期分類

組織学的深達度によってT分類は決定される。T分類はクリニカルステージを決定するのに非常に重要な因子である。
粘膜(M):mucosa、粘膜下層(SM):submucosa、筋層(MP):Tunica muscularis propria、漿膜下層(SS):subserosa、漿膜(S):serosa)
病期(ステージ)は下記表の様に分類される。
| 深さ・転移 | リンパ節転移 | ||||||
|---|---|---|---|---|---|---|---|
| NO | N1 | N2 | N3 | M1 | |||
| 記号 ※ | 解説 | リンパ節転移がない | リンパ節 1〜2個に転移 | リンパ節 3〜6個に転移 | リンパ節 7個以上に転移 | 遠隔への転移 | |
| T1a (M) T1b (SM) | 胃の粘膜・粘膜下層にとどまっている | IA | IB | IIA | IIB | IV | |
| T2 (MP) | 胃の筋層に達している | IB | IIA | IIB | IIIA | IV | |
| T3( SS) | 胃の筋層を越え、漿膜下層に達している | IIA | IIB | IIIA | IIIB | IV | |
| T4a (SE) | がんが漿膜を超え、胃の表面に出ている | IIB | IIIA | IIIB | IIIC | IV | |
| T4b (SI) | がんが胃の表面に出たうえに、 他臓器にもがんが続いている | IIIA | IIIB | IIIC | IIIC | IV | |
| 肝臓、肺、腹膜などに転移している | IV | IV | IV | IV | IV | ||
| ※ 深さ・転移 記号欄中の括弧付き記号は、旧分類による記号(旧ガイドラインで標記される記号。 | |||||||
- 国立がん研究センター がん情報サービスの胃がんの病期(ステージ)分類表[39]より引用し改変。
治療
他の癌の治療と同様に、治療方針は癌の病期によって変わってくる。主に以下にあげられる治療を集学的に行っていく。以下は狭義の胃癌の治療について記述。なお、がん治療には、手術・放射線治療・化学療法の三つがあるが、感染症を原因とする「アジア型のがん」である胃がんの治療には、それが全摘できる例外的な臓器であり、開腹手術で最初に確認できるという点から手術が向いている[40]。
胃悪性リンパ腫・GISTの治療については各項を参照。
内視鏡治療
内視鏡的粘膜下層剥離術(ESD:Endoscopic Submucosal Dissection)
- 分化型でリンパ節転移のない「早期胃癌」と診断される病変に対しては、EMR・ESDといった内視鏡切除治療が広く行われてきている。詳細はEMR・ESDの記述を参照。
また胃GIST等に対しての低侵襲治療として以下のものが行われてきている。
- 腹腔鏡内視鏡合同手術(LECS:Laparoscopy and Endoscopy Cooperative Surgery)[41]
2008年に癌研究会有明病院の比企直樹らが提唱し始めた。
- 非穿孔式内視鏡的胃壁内反切除術(NEWS:Non-exposed Endoscopic Wall-inversion Surgery)
2011年に慶應義塾大学の後藤修らが提唱し始めた。
手術治療
旧来よりまた現在においても、根治術の根本としては外科的手術切除であり、胃切除術+D2リンパ節郭清が根治術の基本である。詳細は胃切除術の記述を参照。
D2以上のリンパ節郭清(No13 14 16)については、症例に応じて検討して行われる。
また、癌の進行が進んでいると術前診断がなされれば、大網膜・脾臓・胆嚢といった周囲他臓器合併切除を行う拡大手術が行われる。発見時には腹膜播種、リンパ節転移など胃以外に転移しているいった進行癌の場合には、先に化学療法などを試み、転移したがん細胞を消すことが出来た場合に手術を行うこともある。また、全身麻酔下での手術に耐えられない場合。高齢である、心疾患がある、など。
化学療法
外科的根治切除治療が困難な進行胃癌や手術治療後の補助療法として化学療法がある。化学療法は様々に組み合わせて用いられ「レジメン」が提唱されている。
- 抗癌剤
5-FU・S-1・Xp or Cape(カペシタビン)
CDDP(シスプラチン・カルボプラチン)・OX(オキサリプラチン)
CPT-11(イリノテカン)- PTX(パクリタキセル・nab-PTX)・DTX(ドセタキセル)
- 分子標的治療薬
- 特定の受容体・酵素に対しての低分子化合物もしくはモノクローナル抗体であり、上皮細胞増殖因子などの細胞の増殖シグナルの阻害や癌細胞の直接傷害により治療する。抗癌剤と組み合わせて治療を行う。
大腸癌などで有用性が認められているベバシズマブの効果は胃癌では認められなかった[42]。ゲフィチニブ、エベロリムス、ラパチニブなどの臨床試験も行われたが、いずれも胃癌では効果は認められなかった。
トラスツズマブ(抗HER2モノクローナル抗体製剤)
ラムシルマブ(RAM 抗VEGFR抗体)
- 免疫チェックポイント阻害剤
- 日本においては3次治療以上において適応推奨されている[43]。ただ全体での奏効率が低いため、いわゆる「効く人」には画期的な薬剤として報道もなされているが、効果が得られない割合も多いことで、適応となる患者の選定が課題でもある。
ニボルマブ(抗PD-1抗体製剤)
- レジメン
- 現在、胃癌に対して行われる化学療法のレジメンは以下の通りである。それぞれガイドラインに準じて選択され、個々の症例に応じて判断される。
- 5-FU療法:JCOG9205
- 5-FU+CDDP療法:JCOG9205
- CPT-11+CDDP療法:JCOG9912
- S-1療法:JCOG9912
- S-1+CDDP療法:SPIRITS試験
- S-1+CPT-11療法:GCO301/TOP-002試験
- S-1+DTX療法:START試験
- Xp+トラスツズマブ療法:ToGA試験
- CPT-11療法:ASCO2009 AIO study
- DTX療法:ASCO2011 Korea study
- PTX療法:ASCO2012 WJOG4007
- nab-PTX療法:
- 5-FU+OX療法:REAL2試験
- S-1+OX療法:G-SOX試験
- Cape+OX療法:REAL2試験とG-SOX試験に準じて
- RAM+PTX療法:RAINBOW試験
- RAM療法:REGARD試験
- Nivolumab単剤療法:ATTRACTION-2 試験
放射線治療
腺癌が多いため、日本では放射線療法は多くは行われない。術後病変に対する治療や、未承認治療法として術中照射(intraoperative radiation therapy)が手術の補助として有効かどうか研究されている。
生物学的療法(免疫療法)
生物学的療法(免疫療法とも呼ばれる)は身体の免疫が癌細胞を攻撃するのを補助する治療法であり、他の治療法の副作用から回復させる補助としても施されることがある。未承認治療法として他の治療法と併用して、再発癌の防止する生物学的治療法研究が医者によって進められているが、2016年秋時点で胃癌に対する有効性が証明された免疫療法は存在しないため、正当な手続きを経て専門機関にて行われる治験以外では実施するべきではない。
別の生物学的治療法として、化学療法中あるいは治療後に(白血球など)血球が減少した患者に、コロニー刺激因子などを投与して血球数レベルの回復の手助けをすることがある。ある種の生物学的治療法を受ける患者は入院が必要な場合がある。
予後
早期に発見され治療が行われれば予後の良い癌である。国立がんセンター中央病院胃癌グループの統計によると、5年生存率は胃癌全体で71.4%、StageIで91.2%、StageIIで80.9%、StageIIIで54.7%、StageIVでは9.4%であった[44]。
出典
JPHC Study=独立行政法人 国立がん研究センター がん予防・検診研究センター 予防研究部発表の多目的コホート研究結果 を示す。
- ^ abcd“Gastric Cancer Treatment (PDQ®)”. NCI (2014年4月17日). 2014年7月5日時点のオリジナルよりアーカイブ。2014年7月1日閲覧。
^ Ruddon, Raymond W. (2007). Cancer biology (4th ed.). Oxford: Oxford University Press. p. 223. ISBN 9780195175431. オリジナルの15 September 2015時点によるアーカイブ。. https://books.google.com/books?id=PymZ1ORk0TcC&pg=PA223.
- ^ abcdefghijkl World Cancer Report 2014. World Health Organization. (2014). pp. Chapter 5.4. ISBN 978-9283204299.
^ Chang, A. H.; Parsonnet, J. (2010年). “Role of Bacteria in Oncogenesis”. Clinical Microbiology Reviews 23 (4): 837–857. doi:10.1128/CMR.00012-10. ISSN 0893-8512. PMC 2952975. PMID 20930075. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2952975/.
^ Sim, edited by Fiona; McKee, Martin (2011). Issues in public health (2nd ed.). Maidenhead: Open University Press. p. 74. ISBN 9780335244225. オリジナルの17 June 2016時点によるアーカイブ。. https://books.google.com/books?id=Jn8xC6_UW8YC&pg=PA74.
^ González CA, Sala N, Rokkas T; Sala; Rokkas (2013年). “Gastric cancer: epidemiologic aspects”. Helicobacter 18 (Supplement 1): 34–38. doi:10.1111/hel.12082. PMID 24011243.
- ^ ab“Chapter 1.1”. World Cancer Report 2014. World Health Organization. (2014). ISBN 978-9283204299.
^ Hochhauser, Jeffrey Tobias, Daniel (2010). Cancer and its management (6th ed.). Chichester, West Sussex, UK: Wiley-Blackwell. p. 259. ISBN 9781444306378. オリジナルの15 September 2015時点によるアーカイブ。. https://books.google.com/books?id=9sW0eCoZFt4C&pg=PA259.
^ Khleif, Edited by Roland T. Skeel, Samir N. (2011). Handbook of cancer chemotherapy (8th ed.). Philadelphia: Wolter Kluwer. p. 127. ISBN 9781608317820. オリジナルの18 September 2015時点によるアーカイブ。. https://books.google.com/books?id=6Nz_87OLrtcC&pg=PA127.
^ Joseph A Knight (2010). Human Longevity: The Major Determining Factors. Author House. p. 339. ISBN 9781452067223. オリジナルの16 September 2015時点によるアーカイブ。. https://books.google.com/books?id=HBY_GxOY_6oC&pg=PA339.
^ Moore, edited by Rhonda J.; Spiegel, David (2004). Cancer, culture, and communication. New York: Kluwer Academic. p. 139. ISBN 9780306478857. オリジナルの15 September 2015時点によるアーカイブ。. https://books.google.com/books?id=kHLlOePrWgYC&pg=PA139.
^ “WHO Disease and injury country estimates”. World Health Organization (2009年). 2009年11月11日閲覧。
^ 研究プロジェクト - 独立行政法人国立がん研究センターがん予防・検診研究センター予防研究グループ
^ 杉満紀子、原田 直彦、岩佐勉、ほか. 鳥肌胃炎に合併した若年者未分化型胃癌の2症例. 臨牀と研究 88(9), 1177-1180, 2011-0 NAID 40019005527
^ ヘリコバクター・ピロリ菌感染と胃がん罹患との関係:CagAおよびペプシノーゲンとの組み合わせによるリスク(2006/09/04) - JPHC Study
^ Ford AC et al. Helicobacter pylori eradication therapy to prevent gastric cancer in healthy asymptomatic infected individuals: Systematic review and meta-analysis of randomised controlled trials. BMJ 2014 May 20; 348:g3174.PMID 24846275
- ^ ab伊藤公訓、小刀崇弘、保田智之 ほか、Helicobacter pylori除菌後の胃がん 日本消化器内視鏡学会雑誌 60巻 (2018) 1号 p.5-13, doi:10.11280/gee.60.5
^ Report of a Joint WHO/FAO Expert Consultation Diet, Nutrition and the Prevention of Chronic Diseases, 2003
^ 食塩・塩蔵食品摂取と胃がんとの関連について 国立がん研究センター 社会と健康研究センター 予防研究グループ
^ 食塩・塩蔵食品摂取と胃がんとの関連について(2004/01/18) - JPHC Study
^ 塩分・塩蔵食品と、がん・循環器疾患の関連について 国立がん研究センター 社会と健康研究センター 予防研究グループ
^ Nozaki K et al. Synergistic promoting effects of Helicobacter pylori infection and high-salt diet on gastric carcinogenesis in Mongolian gerbils. Jpn J Cancer Res 93:1083-9, 2002.PMID 12417037
^ たばこ・お酒と胃がんの関連について(2002/11/20) - JPHC Study
^ アルコール代謝関連遺伝子(アルコール・アルデヒド脱水素酵素)と飲酒量に基づく胃がん罹患について(2015/01/29) - JPHC Study
^ 胃癌のリスクを減らすサプリメントL-システインの効果は二日酔い改善だけではない プレスリリース 東北大学, 2015年4月2日
^ 総コレステロール値とがん発生リスクとの関連(2009/10/15) - JPHC Study
^ 血中のカロテノイドと胃がん罹患との関係について(2008/07/17) - JPHC Study
^ 緑茶飲用と胃がんとの関連について(2004/08/03) - JPHC Study
^ 血中の緑茶ポリフェノールと胃がん罹患との関係について(2008/02/23) - JPHC Study
^ 胃がん検診受診と胃がん死亡率との関係(2006/01/20) - JPHC Study
^ 食生活パターンと胃がんとの関連について(2004/04/16) - JPHC Study
^ 野菜・果物摂取と胃がん発生率との関係について(2002/11/20) - JPHC Study
^ 中原慶太 これなら見逃さない!胃X線読影法 虎の巻. 羊土社 2015, ISBN 978-4-7581-1058-7 , p30
^ “【対談】胃癌を知る――『胃癌の構造』第3版発刊によせて”. 医学書院 (2006年3月6日). 2013年3月17日閲覧。
^ “胃がん検診、内視鏡推奨せず 厚労省 現場から異論も”. 朝日新聞 アピタル. (2013年8月19日). http://apital.asahi.com/article/news/2013081900013.html
^ 胃がんは「ピロリ菌除菌」でなくせる 浅香 正博・秋野公造 (著)潮出版2013/10/5、潮新書2017/3/4
^ 胃がん・乳がん検診に関する指針の改正について 厚生労働省 健康局 がん・疾病対策課 (PDF)
^ 中村常哉 (2005年8月5日). “胃癌診断の基本と最近の話題”. 南圭会. 2013年3月17日閲覧。
^ 胃がんの病期(ステージ)分類 国立がん研究センター がん情報サービス
^ 中川恵一『ドクター中川の"がんを知る"』毎日新聞社、2008年。pp.22-23 ISBN 978-4-620-31868-4
^ 比企直樹、福永哲、三木明 ほか、胃粘膜下腫瘍に対する新しい術式: 腹腔鏡・内視鏡合同胃局所切除 日本消化器外科学会雑誌 2008年 41巻 9号 p.1661-1668, doi:10.5833/jjgs.41.1661
^ Ohtsu A et. al. Bevacizumab in Combination With Chemotherapy As First-Line Therapy in Advanced Gastric Cancer: A Randomized, Double-Blind, Placebo-Controlled Phase III Study. J Clin Oncol. 2011 Oct 20;29(30):3968-76.PMID 21844504
^ “オプジーボ®点滴静注(一般名:ニボルマブ)がん化学療法後に増悪した治癒切除不能な進行・再発の胃癌に対する国内製造販売承認事項一部変更承認取得”. 小野薬品工業、ブリストル・マイヤーズ スクイブ (2017年9月22日). 2018年10月21日閲覧。
^ “がんの統計'03”. 国立がん研究センターがん対策情報センター (2004年12月1日). 2013年3月17日閲覧。
関連項目
- 日本胃癌学会
- 腫瘍学
- 悪性腫瘍
- 消化器学
スキルス - CDH1遺伝子異常家系に多発したとの報告がある。カドヘリンとの関連が示唆されている。
参考文献
- 『胃がん治療ガイドラインの解説 胃がんの治療を理解しようとするすべての方のために 胃癌治療ガイドライン(医師用)2004年』日本胃癌学会 (Minds医療情報サービス)
- 『有効性評価に基づく胃がん検診ガイドライン 2006年』厚労省がん研究班編 (Minds医療情報サービス)
外部リンク
日本胃癌学会
- 胃癌治療ガイドライン
- 国立がんセンター











