アンモニア
| アンモニア | |
|---|---|
 | |
 |
 |
IUPAC名 アザン | |
別称 窒化水素 | |
| 識別情報 | |
CAS登録番号 |
7664-41-7 |
PubChem |
222 |
国連/北米番号 |
無水物:1005 水溶液:2672, 2073, 3318 |
RTECS番号 |
BO0875000 |
SMILES
| |
InChI
| |
| 特性 | |
化学式 |
NH3 |
モル質量 |
17.0306 g mol-1 |
| 外観 |
常温で刺激臭のある無色透明の気体 |
密度 |
0.6942[1] |
融点 |
-77.73 °C, 195 K, -108 °F |
沸点 |
-33.34 °C, 240 K, -28 °F |
水への溶解度 |
89.9 g/100 cm3 (0 ℃) |
酸解離定数 pKa |
38 |
塩基解離定数 pKb |
4.75 (H2Oと反応) |
屈折率 (nD) |
εr |
| 構造 | |
| 分子の形 |
三角錐形 |
双極子モーメント |
1.42 D |
| 熱化学 | |
標準生成熱 ΔfH |
-46.11 kJ mol-1 |
標準燃焼熱 ΔcH |
-382.64 kJ mol-1 |
標準モルエントロピー S |
192.45 J mol-1K-1 |
標準定圧モル比熱, Cp |
35.06 J mol-1K-1 |
| 危険性 | |
安全データシート(外部リンク) |
ICSC:0414(日本語) ICSC 0414(英語) |
NFPA 704 |
 1 3 0 |
Rフレーズ |
R10, R23, R34, R50 |
Sフレーズ |
(S1/2), S16, S36/37/39, S45, S61 |
引火点 |
なし[2] |
発火点 |
651 ℃ |
| 関連する物質 | |
| その他の陰イオン |
塩化アンモニウム 炭酸アンモニウム |
| 関連物質 |
ヒドラジン アジ化水素 ヒドロキシルアミン クロラミン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
アンモニア (英: ammonia) は分子式が NH3{displaystyle {ce {NH3}}}
水に良く溶けるため、水溶液(アンモニア水)として使用されることも多く、化学工業では基礎的な窒素源として重要である。また生体において有毒であるため、重要視される物質である。塩基の程度は水酸化ナトリウムより弱い。
窒素原子上の孤立電子対のはたらきにより、金属錯体の配位子となり、その場合はアンミン[3]と呼ばれる。
- Cu2++4NH3↽−−⇀[Cu(NH3)4]2+{displaystyle {ce {Cu^2+ + 4 NH3 <=> [Cu(NH3)4]^2+}}}
- Ag++2NH3↽−−⇀[Ag(NH3)2]+{displaystyle {ce {Ag^+ + 2 NH3 <=> [Ag(NH3)2]^+}}}
名称の由来は、古代エジプトのアモン神殿の近くからアンモニウム塩が産出した事による。ラテン語の sol ammoniacum(アモンの塩)を語源とする。「アモンの塩」が意味する化合物は食塩と尿から合成されていた塩化アンモニウムである。アンモニアを初めて合成したのはジョゼフ・プリーストリー(1774年)である。
共役酸 (NH4+) はアンモニウムイオン[4]、共役塩基 (NH2-) はアミドイオン[5]である。
目次
1 性質
1.1 液体アンモニア
1.2 毒性
1.3 燃焼
2 アンモニア水
3 アンモニウムイオン
4 アンモニウム塩
5 その他関連物質
6 合成
6.1 主な合成法
7 用途
7.1 化学原料
7.2 冷媒
7.3 火力発電用燃料
7.4 脱硝
8 疾病
9 その他
10 出典
11 参考文献
12 関連文献
13 関連項目
14 外部リンク
性質
アンモニア分子は窒素を中心とする四面体構造を取っており、各頂点には3つの水素原子と一対の孤立電子対を持つ。常温常圧では無色で刺激臭のある可燃性気体。水に非常によく溶け、水溶液は塩基性を示す。
様々な酸と反応して、対応するアンモニウム塩を作る。また、有機反応において求核剤として振る舞う。例えば、ハロゲン化アルキルと反応してアミンを、カルボン酸ハロゲン化物やカルボン酸無水物と反応してアミドを与える。塩化水素(塩酸)を近づけると塩化アンモニウム (NH4Cl) の白煙を生じる。ネスラー試薬では褐色の沈殿を生じる。
液体アンモニア
アンモニアは液化しやすく、20℃では、0.857 MPa (8.46気圧)で液化する。また沸点が-33℃と高いため寒冷地では冬季に自然に液化することもあり得る。液体アンモニアの性質は水と似ている。例えば、様々な物質を溶解し、液体アンモニア自体も水溶液と似た性質を示すことが多い。液体アンモニアの蒸発潜熱は1268 J g-1(0℃)であり、この値は水に次いで大きい。
液体アンモニア中では弱い自己解離が存在し、-33℃(沸点)におけるイオン積は以下の通りである[6]。
2NH3↽−−⇀(NH4+)+NH2−,{displaystyle {ce {2NH3 <=> (NH4^+) + NH2^- ,}}}Ks=10−32.5{displaystyle K_{mbox{s}}=10^{-32.5}}

液体アンモニアの白色ボンベ。日本においては内容物によって塗装色が定められている。
液体アンモニアは単体アルカリ金属、アルカリ土類金属およびユウロピウムなどを溶解する性質を持つ。アルカリ金属、特にセシウムの溶解度は非常に大きく、これらの金属の希薄溶液は溶媒和電子により青色を呈するが、濃厚溶液は金属光沢ブロンズ様の液体となる。液体アンモニアに溶解した金属ナトリウムは、有機反応に利用される。さらに、金属溶液は高濃度で金属的な伝導挙動を示すことが知られている。
比誘電率は-33℃において22.4と水に比べてはるかに低い。無機塩類の液体アンモニアに対する溶解度は一般的に低いが、アンモニアの配位能力によりヨウ化銀(AgI)などは非常によく溶ける。
人体においては、摂取した蛋白質が肝臓で分解される過程でアンモニアが生じ、さらに尿素へと変化する。肝機能が低下するなどしていると「汗がアンモニア臭い」と感じられることがある[7]。またアンモニアを吸引するなどした場合は量によっては危険であるため、血中アンモニア濃度を測定する。また、魚介類などの人間以外の生体については、環境水における濃度を測定する。
毒性
粘膜に対する刺激性が強く、濃度 0.1% 以上のガス吸引で危険症状を呈する。悪臭防止法に基づく特定悪臭物質の一つであり、毒物および劇物取締法においても劇物に指定されている。日本では高圧ガス保安法で毒性ガス及び可燃性ガスに指定され、白色のボンベを用い、「毒性」などの注意書きは赤で書くように定められている。液体状のものが飛散した場合は非常に危険で、特に目に入った場合には失明に至る可能性が非常に高い[8]。高濃度のガスを吸入した場合、刺激によるショックが呼吸停止を誘発することがある[9]。生体において、血中アンモニア濃度が高くなると、中枢神経系に強く働き、意識障害が生じる。
- 急性毒性[9]
- 吸入 ラット LC50 2000ppm/4hr
- 吸入 マウス LC50 4230ppm/4hr
- 吸入 ウサギ LC50 7 mg/m3/1hr
- 吸入 ネコ LC50 7 mg/m3/1hr
- 経口 ラット LD50 350 mg/kg
燃焼
通常の状態における空気中での引火性は知られていない。発火点は651℃で空気中のアンモニア含有量が16–25%で爆発性ガスができる。液体アンモニアはハロゲン、強酸と接触すると激しく反応して爆発・飛散することがある。酸素中では燃焼し、窒素酸化物を発生する[10]。
アンモニア水
アンモニアの水に対する溶解度は気体としては非常に大きく濃厚水溶液が存在し、また密度は濃度と伴に減少し、市販の濃アンモニア水は25〜28%程度のものが多く、26%(d=0.904 g cm-3)のものはモル濃度は13.8 mol dm−3である。アンモニアは水に対しかなり発熱的(すべての気体の溶解熱は発熱的であるが)に溶解し、また溶解に関するギブス自由エネルギー変化も負の値を取るため[11]、水に非常に溶けやすいことになる。これは極性のアンモニア分子が、より極性の強い水分子と水素結合を形成するためである。
- NH3(g)↽−−⇀NH3(aq){displaystyle {ce {NH3(g) <=> NH3(aq)}}}
ΔH∘{displaystyle {mathit {Delta }}H^{circ }}  |
ΔG∘{displaystyle {mathit {Delta }}G^{circ }}  |
ΔS∘{displaystyle {mathit {Delta }}S^{circ }}  |
ΔCp∘{displaystyle {mathit {Delta }}Cp^{circ }}  |
|
|---|---|---|---|---|
| アンモニアの溶解 |
-34.13 kJ mol-1 |
-10.05 kJ mol-1 |
-81.2 J mol-1K-1 |
59 J mol-1K-1 |
またアンモニア水は一部電離し、
NH3(aq)+H2O(l)↽−−⇀NH4+(aq)+OH−(aq){displaystyle {ce {NH3(aq) + H2O(l) <=> NH4^+(aq) + OH^{-}(aq)}}}, Kb=1.8×10−5{displaystyle Kb=1.8times 10^{-}5}
- pKb=4.75{displaystyle {mbox{p}}K_{b}=4.75,}
の酸塩基平衡反応によってアンモニウムイオン NH4+ と水酸化物イオン OH- が生じ塩基性を示す。かつてアンモニア水の塩基性は水酸化アンモニウム NH4OH が生成し、これが電離すると考えられていたが、水溶液中にはそのような化学種は認められず、また低温ではアンモニア一水和物 NH3·H2O が生成するが、これはアンモニア分子と水分子が水素結合したものであり水酸化アンモニウムの構造ではない[12]。
また、弱塩基のアンモニアを中和した塩であるアンモニウム塩は弱酸性を示すが、これはアンモニウムイオンの酸解離による。塩基の強度は共役酸の酸解離定数で表記する場合が多い。
NH4+(aq)↽−−⇀H+(aq) +NH3(aq){displaystyle {ce {NH4^+(aq) <=> H^+(aq) + NH3(aq)}}}, Ka=5.6×10−10{displaystyle Ka=5.6times 10^{-10}}
pKa=9.25{displaystyle =9.25}
アンモニアの塩基解離およびアンモニウムイオンの酸解離に対するエンタルピー変化、ギブス自由エネルギー変化、エントロピー変化および定圧モル比熱変化は以下の通りである[11]。アンモニアの塩基解離に関しては電荷の増加による、水和の増加に伴いエントロピーの減少が見られるが、アンモニウムイオンの酸解離に関しては、電荷は変化しないためエントロピー変化は小さい[13]。
ΔH∘{displaystyle {mathit {Delta }}H^{circ }}  |
ΔG∘{displaystyle {mathit {Delta }}G^{circ }}  |
ΔS∘{displaystyle {mathit {Delta }}S^{circ }}  |
ΔCp∘{displaystyle {mathit {Delta }}Cp^{circ }}  |
|
|---|---|---|---|---|
| アンモニアの塩基解離 |
3.62 kJ mol-1 |
27.08 kJ mol-1 |
-78.6 J mol-1K-1 |
-210 J mol-1K-1 |
| アンモニウムイオンの酸解離 |
52.22 kJ mol-1 |
52.81 kJ mol-1 |
-2.1 J mol-1K-1 |
-14 J mol-1K-1 |
アンモニウムイオン

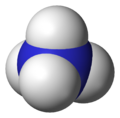
アンモニウムイオン (ammonium) はアンモニアに水素イオンが付加(配位結合)することにより生成し、アンモニア水の電離によっても一部生成する1価の陽イオンであり、オニウムイオンの一種である。正四面体型構造をとる。
アンモニウム塩
アンモニウムイオンを含むイオン結晶をアンモニウム塩(アンモニウムえん、ammonium)と呼び、アンモニアと酸との中和反応によっても生成する。多くのものが水に可溶であるが、過塩素酸塩、ヘキサクロロ白金酸塩などは溶解度が低く、アンモニウム塩の溶解度はアンモニウムイオンとイオン半径の近い、カリウム塩およびルビジウム塩に類似する。加熱により分解し、過塩素酸アンモニウムなどは爆発する。
- 無機アンモニウム塩
塩化アンモニウム NH4Cl(塩安)
過塩素酸アンモニウム NH4ClO4
硫酸アンモニウム (NH4)2SO4(硫安)
硝酸アンモニウム NH4NO3(硝安)
炭酸アンモニウム (NH4)2CO3(炭安)
その他関連物質
- 有機アンモニウム塩
酢酸アンモニウム CH3COONH4
クロラミン NH2Cl, NHCl2, NCl3(アンモニアの水素原子を塩素原子でいくつか置換したもの)- アンモニアの酸化体としては硝酸やヒドラジンなどがある。
第四級アンモニウムカチオン R4N+
合成
現在ではアンモニアの工業生産はハーバー・ボッシュ法によるものが一般的である。実際のプラントでは水素と窒素を鉄触媒存在下 25〜35 MPa、約500℃ で反応させると[14]、
- N2+3H2⟶2NH3{displaystyle {ce {N2 + 3H2 -> 2NH3}}}
の反応によってアンモニアが生成する。
主な合成法
実験室レベルでは、アンモニア水を加熱するか、塩化アンモニウムと水酸化カルシウムを混合し熱するなどの方法で発生させることができる。水への溶解度が大きく、空気の平均分子量より小さいため、吸湿して構わないならば上方置換によって集めることができる。
- 高電圧放電法(1905年、ビルケランド・アイデ法)
- 雷と同じ方法で、空中で火花放電させて窒素と酸素から酸化窒素NOを作り最後に硝酸とする。1905年に実用化したが、電力消費が極めて大きい[14]。
- N2+O2 →3000∘C 2NO →600∘CO2 2NO2 →H2O 2NHO3{displaystyle mathrm {{N_{2}}+{O_{2}} {xrightarrow[{3000^{circ }{C}}]{ }} 2NO {xrightarrow[{600^{circ }{C}}]{O_{2}}} 2NO_{2} {xrightarrow {H_{2}O}} 2NHO_{3}} }
- 石灰窒素法(1906年,フランク・カロ法)
- 1901年ドイツ人フランクとカロによる方法で、カルシウム・カーバイド(CaC2){displaystyle {{ce {(CaC2)}}}}
を窒化させて石灰窒素を合成する手法。電力は放電法の1/4[14]。
- CaO →2000∘C3C CaC2 →1000∘CN2 CaCN2 →3H2O 2NH3{displaystyle mathrm {{CaO} {xrightarrow[{2000^{circ }{C}}]{3C}} CaC_{2} {xrightarrow[{1000^{circ }{C}}]{N_{2}}} CaCN_{2} {xrightarrow {3H_{2}O}} 2NH_{3}} }
ルテニウム触媒(Ru-活性炭-K)- 尾崎、秋鹿らによるハーバー法よりも温和な条件でアンモニアを合成できるルテニウム触媒を用いた合成法[15][16]。
- C12A7 Electride
- アルミナセメントの構成成分を用いる方法で、常圧 320〜400℃で合成可能[17]。
- モリブデン錯体
- 2010年にはレンゲの酵素構造を参考にして、モリブデンを含む触媒により常温常圧でアンモニアを合成する手法が発表された[18][19]。
- ランタンコバルト金属間化合物 (LaCoSi)
- 貴金属触媒を使用しない方法[20]。
用途
化学原料
アンモニアは硝酸などの基礎化学品、硫安などチッソ肥料の原料となるため、工業的に極めて重要な物質である。2008年度日本国内生産量は 1,244,083t、消費量は 403,841t である[21]。全世界の年間生産量(2010年)は1.6億tで、そのうち8割が肥料用であると言われている[22]。
ソルベー法が盛んに用いられた時期には炭酸ナトリウムを製造するための原料だった。
冷媒
液化したアンモニアはバーチ還元の溶媒として使用される。また、蒸発熱が大きいため (5.581 Kcal/mol)、冷蔵機・冷凍機の冷媒として利用されているが、小型の機器では吸収式冷凍機を除きそのほとんどがフロンなどに替わられた。しかし新しい冷媒に比べオゾン層の破壊係数が少ないことから、最近この用途で見直されつつある[23]。また人工衛星などの宇宙開発用機器の冷却にも多く用いられている。
火力発電用燃料
前述のようにアンモニアは条件次第で燃焼し、燃やしても代表的な温暖化ガスである二酸化炭素が発生しない。このためアンモニアを火力発電用燃料として使う技術開発が行われている。微粉炭と混焼させたり[24]、ガスタービン発電で燃料や空気の供給量・速度を調整したり[25]する方法等が研究されている。
脱硝
環境に有害な窒素酸化物の発生を抑制するために火力発電所のボイラーなどに設置される、選択触媒還元脱硝装置の還元剤として使用される[26]。
- その他の用途例
推進剤 - 燃料電池やXLR99のようなロケット燃料。
19世紀末にはアメリカ合衆国で Emile Lamm が1870年と1872年にアンモニアを動力源として使用する機関車に関する特許を取得して[27][28]ニューオーリンズで1872年に作動流体として圧縮空気や蒸気の代わりにアンモニアを使用する無火機関車が馬車鉄道の代わりに使用された[29]。費用は1日当たり$6.775で、動物による牽引では1日当たり$9.910だった。
銀鏡反応を利用した銀めっきの還元剤としても使用される。- 強烈な刺激臭のため、気絶した人に気付け薬として嗅がせることがある。また 9.5–10.5% のアンモニア水溶液は日本薬局方一部医薬品(日本薬局方アンモニア水)で虫刺され用の外用薬の成分として用いられることもある[30]。ただし、アンモニア自体はギ酸などには中和が期待されるものの、ヒスタミンなどに対する分解作用は無い。
疾病
ヒトの体内におけるアンモニアは血液によって運ばれ肝臓によって処理される[31]が、肝臓病などの疾病においてその処理機能が低下すると、高アンモニア血症を発症し脳障害など重大な影響を及ぼす[32]。
その他
食品、特に動物性食品の蛋白質やアミノ酸が微生物に分解されるとアンモニアが発生し、一定の量を超えればいわゆる腐敗臭を放つようになる。アンモニアには毒性があるが、微量であれば食物の風味付けに利用される。くさややホンオフェなど、刺激臭のする発酵食品の臭気の主成分の一つはアンモニアである。またアンモニアは食品添加物として認められ、パンや洋菓子などの生地の膨張剤として使用される。この場合アンモニアは加熱過程で消散し、製品に残留しないことが要求されている。
サメの体内にはアンモニアがあるために腐敗が遅い。冷蔵技術が普及する前、日本の山間部では、腐敗や食中毒を起こさずに海岸部から運んでこられるサメが海の幸として珍重されていた[33]。
アンモニアは、また体内でも生成される。食物に含まれる蛋白質や、腸の分泌液に含まれる尿素が腸内細菌によって分解されるとアンモニアが生産され、血液中に放出される。血中アンモニアは肝臓で尿素やグルタミンに変換され、無毒化される。薬剤や肝硬変などで肝機能が低下したときには体内にアンモニアが蓄積され、肝性脳症[34]を発症する(アンモニアは容易に血液脳関門を通過し、脳にダメージを与える。)。
生物は、蛋白質など代謝の結果で不要となった窒素を貯蔵、排泄しなければならない。硬骨魚類や両生類の幼生では主にアンモニアの形でそのまま排泄されるが、軟骨魚類、哺乳類や両生類の成体では主に尿素、爬虫類の多くや鳥類では尿酸に変換された上で貯蔵、排泄される。
電子技術総合研究所で神経回路の伝達の研究に使用されていたヤリイカの飼育は当初困難だったが、松本元により、アンモニアを除去するために循環濾過フィルター内にアンモニアを酸化する細菌(亜硝酸菌)と、それを還元する細菌(嫌気呼吸菌、脱窒菌)の繁殖・保持により達成された。これは現在の海水魚飼育で、基本的な技術となっている[35]。
ウシなどではタンパク質などの過剰摂取により第一胃内および血液中のアンモニア濃度が上昇し、アンモニア中毒となることがある。
室内アンモニア濃度が20ppm以上の状態でラットを長時間飼育すると呼吸器系の炎症を引き起こす。
出典
^ NIST Chemistry WebBook (website page of the National Institute of Standards and Technology) URL last accessed 15 May 2007
^ MSDS Sheet from W.D. Service Co.
^ 英: ammine
^ 英: ammonium ion
^ 英: amide ion
^ シャロー 『溶液内の化学反応と平衡』 藤永太一郎、佐藤昌憲訳、丸善、1975年
^ 汗が臭くなる病気沢井製薬(2017年7月)2018年4月12日閲覧。
^ ミステリーの毒を科学する 講談社ブルーバックス 山崎昶 1992 ISBN 978-4-06-132919-5
- ^ abアンモニア 化学物質安全シート 高千穂科学工業 (PDF)
^ MSDS 液体アンモニア (PDF)
- ^ abD.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney, R.I. Nuttal, K.L. Churney and R.I. Nuttal, The NBS tables of chemical thermodynamics properties, J. Phys. Chem. Ref. Data 11 Suppl. 2 (1982)
^ FA コットン, G. ウィルキンソン著, 中原 勝儼訳 『コットン・ウィルキンソン無機化学』 培風館、1987年、原書:F. ALBERT COTTON and GEOFFREY WILKINSON, Cotton and Wilkinson ADVANCED INORGANIC CHEMISTRY A COMPREHENSIVE TEXT Fourth Edition, INTERSCIENCE, 1980.
^ 田中元治 『基礎化学選書8 酸と塩基』 裳華房、1971年
- ^ abc江崎正直、アンモニア合成 (PDF)
^ 秋鹿研一、小山建次、山口寿太郎 ほか、アンモニア合成用カリウム金属添加ルテニウムおよびオスミウム触媒の製法に関する研究 日本化学会誌 Vol.1976 (1976) No.3 P.394-398, doi:10.1246/nikkashi.1976.394
^ 秋鹿研一『化学と教育』第10巻、1994年、 680 - 684頁。
^ 北野政明、原亨和、 細野秀雄、電子化物を利用したアンモニア合成用触媒材料の開発 スマートプロセス学会誌 Vol.2 (2013) No.6 p.293-298, doi:10.7791/jspmee.2.293
^ K. Arashiba, Y. Miyake and Y. Nishibayashi, A molybdenum complex bearing PNP-type pincer ligands leads to the catalytic reduction of dinitrogen into ammonia, Nature Chem. 3, 120-125 (2011).
^ 世界最高の活性を示すアンモニア合成触媒の開発に成功 東京大学、九州大学、科学技術振興機構
^ 貴金属を使わない高性能アンモニア合成触媒を開発 東京工業大学、Yutong Gong, Jiazhen Wu, Masaaki Kitano, Junjie Wang, Tian-Nan Ye, Jiang Li, Yasukazu Kobayashi, Kazuhisa Kishida, Hitoshi Abe, Yasuhiro Niwa, Hongsheng Yang, Tomofumi Tada & Hideo Hosono., Ternary Intermetallic LaCoSi as a Catalyst for N2 Activation(日本語タイトル:窒素分子の活性化触媒としての3元系金属間化合物LaCoSi)., Nature Catalysis, doi:10.1038/s41929-017-0022-0
^ 経済産業省生産動態統計・生産・出荷・在庫統計平成20年年計による
^ http://www.ueri.co.jp/jhif/12Conference090610/doshisyauniv.pdf
^ 「自然冷媒(アンモニア)高効率ヒートポンプチラー」の開発・販売について 〜地球環境にやさしいアンモニア冷媒を採用、4月より販売開始〜 2004年3月30日 東京電力
^ 石炭火力発電所向け 燃焼試験設備で世界最高水準のアンモニア混焼を実証~CO2排出量低減に寄与 アンモニアの燃料利用を可能にする燃焼技術を開発~IHIプレスリリース(2018年3月28日)2018年4月12日閲覧。
^ アンモニアを直接燃焼させる 炭素を含まない燃料による火力発電科学技術振興機構(2018年4月12日閲覧)。
^ 「排煙脱硝装置 (PDF) 」 、『エネルギア総研レビュー』第33巻第3号、エネルギア総研、2013年、 23頁、2018年10月7日閲覧。
^ アメリカ合衆国特許第125,577号
^ アメリカ合衆国特許第105,581号
^ Louis C. Hennick; Elbridge Harper Charlton (1965). The Streetcars of New Orleans. Pelican Publishing. p. 14-16. ISBN 9781455612598.
^ 「キンカン」など。
^ 坂口力、環境要因とアンモニア代謝 第1報: 各種環境要因における脳, 肝, 血液のアンモニア濃度変化 日本衛生学雑誌
Vol. 19 (1964-1965) No. 6 P 369-373, doi:10.1265/jjh.19.369
^ 福嶋真理恵、古藤和浩、遠城寺宗近 ほか、バルプロ酸ナトリウムにより高アンモニア血症をきたしたC型慢性肝炎の1例 日本消化器病学会雑誌 Vol.102 (2005) No.1 P42-47, doi:10.11405/nisshoshi.102.42
^ “新年企画 食べるって何だ? 郷土の味 知恵凝縮”. 朝日新聞栃木版 (朝日新聞社). (2009年1月1日). http://mytown.asahi.com/tochigi/news.php?k_id=09000360901010002 2009年8月10日閲覧。
^ 加藤章信、鈴木一幸、肝性脳症: 診断·検査 日本消化器病学会雑誌 Vol. 104 (2007) No. 3 P 344-351, doi:10.11405/nisshoshi.104.344
^ “ヤリイカの人工飼育”. 松本 元先生 メモリアルサイト. ブレインビジョン株式会社. 2011年12月15日閲覧。
参考文献
- 光岡知足ほか編集 『獣医実験動物学』 川島書店 1990年 ISBN 4-7610-0428-2
関連文献
「アンモニア合成に新手法」、『msn 産経ニュース』2010.12.14 07:44、The Sankei Shimbun & Sankei Digital、2010年12月14日(火)閲覧。-- 東京大学大学院・触媒反応工学の研究グループが製造コストが安価なアンモニア合成方法を開発し、英国の科学誌 "Nature Chemistry" の電子版に発表された。アンモニアを燃焼させて熱エネルギーを取り出す場合、その際の排出物質は窒素と水だけである。二酸化炭素を排出しないので、次世代のエネルギー源になる可能性がある。
Kazuya Arashiba; Yoshihiro Miyake; Yoshiaki Nishibayashi, “A molybdenum complex bearing PNP-type pincer ligands leads to the catalytic reduction of dinitrogen into ammonia”, Nature Checmistry (05 December 2010), http://www.nature.com/nchem/journal/vaop/ncurrent/full/nchem.906.html 2010年12月14日(火)閲覧。
関連項目
- 水素化合物
- 窒素固定
- 石炭化学
- 石油化学
外部リンク
- 日本大百科全書(ニッポニカ)『アンモニア』 - コトバンク
| ||||||||||
| ||||||||




![{displaystyle {ce {Cu^2+ + 4 NH3 <=> [Cu(NH3)4]^2+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/482f9df65bf2a99901898b1f35e0f2ef075da9fa)
![{displaystyle {ce {Ag^+ + 2 NH3 <=> [Ag(NH3)2]^+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a9b3c918c51367211454d4d83b9c78b8e628f49c)







![{displaystyle mathrm {{N_{2}}+{O_{2}} {xrightarrow[{3000^{circ }{C}}]{ }} 2NO {xrightarrow[{600^{circ }{C}}]{O_{2}}} 2NO_{2} {xrightarrow {H_{2}O}} 2NHO_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d1c45f80a09c2ad2afef3f620e9159b7520d8bb)
![{displaystyle mathrm {{CaO} {xrightarrow[{2000^{circ }{C}}]{3C}} CaC_{2} {xrightarrow[{1000^{circ }{C}}]{N_{2}}} CaCN_{2} {xrightarrow {3H_{2}O}} 2NH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/79ab1d432eaa14cee2173352df151eddb6ccb7cf)