トリフルオロメタンスルホン酸
| トリフルオロメタンスルホン酸 | |
|---|---|
 | |
 | |
IUPAC名 Trifluoromethanesulfonic acid | |
別称 Triflic acid | |
| 識別情報 | |
CAS登録番号 | 1493-13-6 |
PubChem | 62406 |
ChemSpider | 56192 |
SMILES
| |
InChI
| |
| 特性 | |
化学式 | CF3SO3H |
モル質量 | 150.08 g/mol |
示性式 | CF3SO3H |
| 外観 | 無色の液体 |
密度 | 1.696 g/mL |
融点 | -40 °C |
沸点 | 162 °C |
水への溶解度 | 混和性 |
| 危険性 | |
主な危険性 | 腐食性、目に刺激性 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
トリフルオロメタンスルホン酸(トリフルオロメタンスルホンさん、trifluoromethanesulfonic acid)は、有機化合物で、スルホン酸の一種。フッ素の高い電気陰性度により、硫酸の約 1000 倍という非常に強い酸性を示す(酸度関数による比較)。英語では、triflic acid とも呼ばれ、有機合成において、酸触媒として用いられる[1][2]。また、構造式ではトリフルオロメチルスルホニル基 (CF3SO2−) を Tf と略することから、トリフルオロメタンスルホン酸を TfOH と略することもある。毒物及び劇物取締法により劇物に指定されている[3]。
目次
1 性質
2 歴史と合成法
3 無機反応
4 有機反応
5 トリフルオロメチルスルホニル基
6 参考文献
7 関連項目
性質
トリフルオロメタンスルホン酸は吸湿性を持ち、常温では無色の液体である。湿気を含む空気中に出すと煙を発生し、強い刺激臭を示す。多くの金属を侵す。水には激しく発熱して溶解し、アルコール類、DMF、DMSO、アセトニトリル、ジメチルスルホンなどの極性溶媒に対しても発熱的に溶ける。
一水和物 (CF3SO3H⋅H2O{displaystyle {ce {CF3SO3Hcdot H2O}}}

酸解離定数 pKa は 2.6(アセトニトリル中)[4]、ハメットの酸度関数 H0 は −14.9 である[要出典]。硫酸を上回る非常に強い酸性により、超酸に分類される。
トリフルオロメタンスルホン酸、およびその共役塩基(CF3SO3−{displaystyle {{ce {CF3SO3-}}}}
歴史と合成法
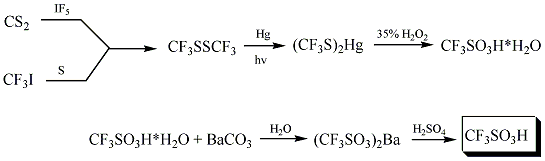
トリフルオロメタンスルホン酸は Haszeldine と Kidd により1954年に、二硫化炭素とトリフルオロヨードメタンから次のような手法で初めて合成された。
メチルトリフルオロメチルスルフィドから電気化学的に合成する手法や、メタンスルホン酸のフッ素化による合成法も知られる。
無機反応
トリフルオロメタンスルホン酸は金属の炭酸塩や水酸化物塩と発熱的に反応して、トリフルオロメタンスルホン酸塩を与える。銅塩の合成例を示す。
- CuCO3 +2CF3SO3H⟶Cu(O3SCF3)2 +H2O +CO2{displaystyle {ce {CuCO3 + 2 CF3SO3H -> Cu(O3SCF3)2 + H2O + CO2}}}
コバルトのクロロ錯体から対アニオンを交換する反応も知られる。この反応はトリフルオロメタンスルホン酸を溶媒として用い、100 ℃で進行させる。反応後はジエチルエーテルを加えて生成物を沈降させる。
- 3CF3SO3H +[Co(NH3)5Cl]Cl2⟶ [Co(NH3)5O3SCF3](O3SCF3)2 +3HCl{displaystyle {ce {3 CF3SO3H + [Co(NH3)5Cl]Cl2 -> [Co(NH3)5O3SCF3](O3SCF3)2 + 3 HCl}}}
有機反応
トリフルオロメタンスルホン酸は、カルボン酸ハロゲン化物と反応して混合酸無水物となる。これは非常に強いアシル化剤であり、フリーデル・クラフツ反応の基質として用いられる。
- CH3C(O)Cl +CF3SO3H⟶CH3C(O)OSO2CF3 +HCl{displaystyle {ce {CH3C(O)Cl + CF3SO3H -> CH3C(O)OSO2CF3 + HCl}}}
- CH3C(O)OSO2CF3 +C6H6⟶CH3C(O)C6H5 +CF3SO3H{displaystyle {ce {CH3C(O)OSO2CF3 + C6H6 -> CH3C(O)C6H5 + CF3SO3H}}}
反応は自己触媒的で、系中で発生する酸が、さらに別の混合酸無水物分子を活性化させて芳香族化合物との反応を進行させる。
トリフルオロメチルスルホニル基
トリフルオロメタンスルホン酸から OH 部分を取り去った、化学式が CF3S(=O)2- と表される1価の置換基は トリフルオロメチルスルホニル基 (trifluoromethylsulfonyl group) 、あるいは トリフリル基 (triflyl group) と呼ばれる。強い電子求引性を示す。
参考文献
^ 総説: Howells, R. D.; McCown, J. D. Chem. Rev. 1977, 77, 69. (doi:10.1021/cr60305a005)
^ 総説: Lakshminarayanapuram, R. S. "Trifluoromethanesulfonic Acid" In Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley & Sons, Ltd.
^ 毒物及び劇物指定令 昭和四十年一月四日 政令第二号 第二条 七十四の五
^ Fujinaga, T.; Sakamoto, I. J. Electroanal. Chem. 1977, 85, 185.
関連項目
- トリフルオロメタンスルホン酸塩
- トリフルオロメタンスルホン酸トリメチルシリル
- 超強酸



![{displaystyle {ce {3 CF3SO3H + [Co(NH3)5Cl]Cl2 -> [Co(NH3)5O3SCF3](O3SCF3)2 + 3 HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9a66c4e126f92bb97cc66f8ae460a61f6f74619b)

