ナビキシモルス
 | |
 | |
| 成分一覧 | |
|---|---|
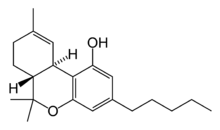
| テトラヒドロカンナビノール | カンナビノイド |
| カンナビジオール | カンナビノイド |
| 臨床データ | |
| 販売名 | サティベックス |
| 法的規制 |
|
| 投与方法 | 口腔内スプレー |
| 識別 | |
CAS番号 | 56575-23-6 |
| ATCコード | N02BG10 (WHO) |
| PubChem | CID: 44148067 |
ナビキシモルス(Nabiximols:USAN[1]、商標名サティベックス:Sativex)は、イギリスの会社GWファーマシューティカルズによって開発された、多発性硬化症(MS)患者の神経因性疼痛、痙縮、過活動膀胱、ほかの症状の緩和に用いられる、特許されたカンナビノイド口腔用スプレーである。2005年に承認されたナビキシモルスは初の大麻由来の製品であり、以前からあるドロナビノールやナビロンは合成THCである[2]。またナビキシモルスは、がんによる疼痛を緩和する可能性のある治療としてフェーズIII試験が実施されている。また、末梢および中枢の神経因性疼痛の様々なモデルで研究されている。ナビキシモルスは、単に合成製造するのではなく大麻植物から抽出しているため、現在利用できる他の全ての製薬的に生産されたカンナビノイドとは異なる。薬は、組成、処方、用量の規格化された製薬製品だが、それでも事実上大麻植物のチンキである。主な活性カンナビノイド成分はカンナビノイドである:テトラヒドロカンナビノール(THC)とカンナビジオール(CBD)。製品は口腔内にスプレーすることで服用される口腔用スプレーのように明確に述べられる。1スプレーにつき、2.7mgのTHCと2.5mgのCBDの一定用量が投与される。
2003年5月、GWファーマシューティカルズとバイエルは、商標名サティベックスで販売されるGWの大麻に基づいた薬草抽出物製品の独占販売契約を結んだ。"バイエルはイギリスでのサティベックスの販売独占権を得ている。さらにバイエルは、欧州連合のほかの国と世界中の選択されたほかの国における販売権を交渉する期間限定の選択権を持っている"
2011年4月、GWはノバルティスに、アジア(日本と中国を除く)、アフリカと中東(イスラエルを除く)でナビキシモルスを商品化する権利をライセンスした。[3]
目次
1 利用
2 有効性
3 副作用
4 議論
5 関連項目
6 脚注
7 外部リンク
利用
2005年にカナダで初めて承認された[2]。2016年末には30か国で使われている[4]。
2010年6月、イギリスの医薬品・医療製品規制庁は、多発性硬化症による痙縮の治療用の処方箋薬としてナビキシモルスを認可した。この規制局認可は医薬品のための世界初の全面的な規制承認を示している。スプレーはイギリスでバイエル・シエーリング・ファーマによって販売されている。多くのMS患者は、地元のNHS一時医療トラストがその財政支援に抵抗するのが原因でナビキシモルスを受け取れない。[5][6]
ナビキシモルスはまた、2010年後半にスペインでMSの痙縮に対し認可され、2011年3月には発売された。チェコ共和国では2011年4月に、ドイツでは2011年5月に、デンマークでは2011年6月に認可された。イタリア、スウェーデン、オーストリアで認可のために提言され、2011年中にこれらの国で正式な認可が待たれている。スペインとほかの欧州市場(イギリスを除く)では、ナビキシモルスはアルミラールにより販売される。
カナダでは、ナビキシモルスはカナダ保健省によってMSの痙縮の治療用に認可されている。それはまた、2つの追加の用途について条件付き承認(NOC/c)を受けている:多発性硬化症における神経因性疼痛の症状緩和のための補助治療として[7]、それから、がんによる疼痛に対して。[8][9]
ナビキシモルスは多くの国で無許可医薬品として利用でき、医師は個々の患者が恩恵を得るとみなすなら製品を処方できる。
2007年2月、GWと大塚製薬は、大塚がアメリカでこの医薬品を開発販売するための独占契約を結んだと発表した。がん患者に対する初の大規模米国フェーズIIb試験のスプレー・トライアルは、2010年3月に良好な結果を伝えた。GWと大塚は、現在、癌性疼痛でのナビキシモルスのフェーズIIIを開始している。
有効性
MS患者の治療を調査する2つの予備的なフェーズIII研究で、一方は0から10点の評価基準で1.2点の痙性の減少を示し(対して偽薬では0.6点)、もう一方は1.0対0.8点の減少を示した。ひとつ目の研究だけ統計的有意に達した。フェーズIII承認試験は、薬剤に対する個々の反応を決定した馴らしフェーズから構成される。第2の偽薬対照された研究のフェーズで、反応者(患者の42%)は有意な効果を示した。[10]2009年の6つの研究のメタ分析は、痙縮の減少傾向と有効性の広い変動を見出した。[11]
2016年のレビューでは、無作為化され制御された臨床研究にてその有効性は確認されており、良好な安全性の特徴を備えているため、多発性硬化症の患者の多くは、従来の薬物治療の限られた有効性に不満があり、中等症から重症の患者にとってナビキシモルスは治療の選択肢となりえると結論されている[12]。
副作用
初期の臨床試験では、ナビキシモルスは概して良好な容認性であった。[13][14][15]フェーズIII試験での最も頻度の高い副作用は、目まい(25%)、眠気(8.2%)、失見当識(4%)であった。患者の12%が副作用により薬の服用を中止した。依存の可能性に関する調査はないが、そのような可能性は2つの化学成分の薬理学的特性を考慮すればなさそうである。[10]
議論
GWファーマシューティカルズは、イギリスでサティベックスの製造のために大麻を栽培する唯一のライセンスが与えられている。
内容は同じであるのにかかわらず、イギリスでは植物の大麻は最も厳しいスケジュールIに該当する規制がなされており、サティベックスはスケジュールIVである。また研究に際してどのようなライセンスを与えればよいのかという問題のため、研究が進展しづらい。大麻が医学的に用いられてきた歴史にもかかわらず、害を防止するという名目で、国連がスケジュールIに指定しているためである。[16]
関連項目
- 医療大麻
- ナビロン
- ドロナビノール
- en:Hortapharm B.V.
脚注
^ United States Adopted Names Coincil: Statement on a nonproprietary name
- ^ abPain, Stephanie (2015). “A potted history”. Nature 525 (7570): S10–S11. doi:10.1038/525S10a. PMID 26398731. https://www.nature.com/nature/journal/v525/n7570_supp/full/525S10a.html.
^ “GW signs Sativex cannabis-based drug deal with Novartis”. The Telegraph. (2011年4月11日). http://www.telegraph.co.uk/finance/newsbysector/pharmaceuticalsandchemicals/8443914/GW-signs-Sativex-cannabis-based-drug-deal-with-Novartis.html 2012年7月12日閲覧。
^ Debra Borchardt (2016年12月9日). “英製薬会社、臨床試験結果に自信も「トランプ大統領」に不安”. フォーブス日本版. https://forbesjapan.com/articles/detail/14490 2017年9月1日閲覧。
^ Ryan, Siobhan (2011年6月4日). “Sussex MS sufferers call for drug funding”. Argus (Sussex,UK). http://www.theargus.co.uk/news/9064713.Sussex_MS_sufferers_call_for_drug_funding/ 2011年6月8日閲覧。
^ “Sativex rejected by healthcare provider”. Lincolnshire (2011年6月20日). 2011年6月20日閲覧。
^ GW Pharmaceuticals. "Multiple Sclerosis". Accessed 24 July 2011.
^ GW Pharmaceuticals. "Cancer Pain" Accessed 24 July 2011.
^
“Sativex - Investigational Cannabis-Based Treatment for Pain and Multiple Sclerosis Drug Development Technology”. www.drugdevelopment-technology.com. 2008年8月8日閲覧。
- ^ abSchubert-Zsilavecz, M, Wurglics, M, Neue Arzneimittel 2011/2012 (ドイツ語)
^ Lakhan, Shaheen E; Rowland, Marie (2009). “Whole plant cannabis extracts in the treatment of spasticity in multiple sclerosis: a systematic review”. BMC Neurol 9: 59. doi:10.1186/1471-2377-9-59. PMC 2793241. PMID 19961570. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2793241/.
^ Zettl, Uwe K.; Rommer, Paulus; Hipp, Petra; et al. (2016). “Evidence for the efficacy and effectiveness of THC-CBD oromucosal spray in symptom management of patients with spasticity due to multiple sclerosis”. Therapeutic Advances in Neurological Disorders 9 (1): 9–30. doi:10.1177/1756285615612659. PMC 4710104. PMID 26788128. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4710104/.
^ Wade D, Makela P, Robson P, House H, Bateman C (2004). “Do cannabis-based medicinal extracts have general or specific effects on symptoms in multiple sclerosis? A double-blind, randomized, placebo-controlled study on 160 patients”. Mult Scler 10 (4): 434–41. doi:10.1191/1352458504ms1082oa. PMID 15327042.
^ Wade D, Makela P, House H, Bateman C, Robson P (2006). “Long-term use of a cannabis-based medicine in the treatment of spasticity and other symptoms in multiple sclerosis”. Mult Scler 12 (5): 639–45. doi:10.1177/1352458505070618. PMID 17086911.
^ Wade D, Robson P, House H, Makela P, Aram J (2003). “A preliminary controlled study to determine whether whole-plant cannabis extracts can improve intractable neurogenic symptoms”. Clin Rehabil 17 (1): 21–9. doi:10.1191/0269215503cr581oa. PMID 12617376.
^ Nutt, David (2015). “Illegal Drugs Laws: Clearing a 50-Year-Old Obstacle to Research”. PLOS Biology 13 (1): e1002047. doi:10.1371/journal.pbio.1002047. PMC 4307971. PMID 25625189. https://doi.org/10.1371/journal.pbio.1002047.
外部リンク
GW Pharmaceuticals Website (英語)
