オクタカルボニル二コバルト
| オクタカルボニル二コバルト | |
|---|---|
 | |
 | |
IUPAC名 octacarbonyldicobalt(0) | |
別称 コバルトカルボニル 二コバルトオクタカルボニル オクタカルボニルジコバルト ジコバルトオクタカルボニル | |
| 識別情報 | |
CAS登録番号 |
10210-68-1 |
国連/北米番号 |
|
RTECS番号 |
GG0300000 |
| 特性 | |
化学式 |
Co2(CO)8 |
モル質量 |
341.95 g/mol |
| 外観 |
橙色固体 |
密度 |
1.87 g/cm3 |
融点 |
51-52 °C |
沸点 |
52 °C(分解) |
水への溶解度 |
不溶 |
| 構造 | |
双極子モーメント |
0 D |
| 危険性 | |
安全データシート(外部リンク) |
ICSC 0976 |
主な危険性 |
有毒 (T) |
| 関連する物質 | |
| 関連する金属カルボニル |
鉄カルボニル ノナカルボニル二鉄 ニッケルカルボニル |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
オクタカルボニル二コバルト (英: octacarbonyldicobalt) とは、分子式が Co2(CO)8 と表されるコバルトの錯体の一種。コバルトカルボニル、二コバルトオクタカルボニル、オクタカルボニルジコバルト、ジコバルトオクタカルボニル とも称される。有機金属化学で試薬として用いられ、関係するいくつかの有機合成反応が知られる[1]。ヒドロホルミル化反応の触媒としても利用される[2]。純度の高い結晶は橙色で、空気中に放置すると褐色を帯び、さらに自然発火することがある。水素と一酸化炭素の雰囲気中では安定である。水に不溶。
目次
1 合成
2 分子構造
3 反応
4 安全性
5 参考文献
合成
オクタカルボニル二コバルトは、コバルト(II)の塩を高圧の一酸化炭素と反応させて合成される。その際にシアン化物の塩が添加されることがある。
炭酸コバルト(II)へ水素と一酸化炭素を加圧して合成する方法も知られる[3]。
- 2CoCO3+2H2+8CO⟶Co(CO)8+2H2O+2CO2{displaystyle {ce {{2CoCO3}+ {2H2}+ 8CO -> {Co(CO)8}+ {2H2O}+ 2CO2}}}
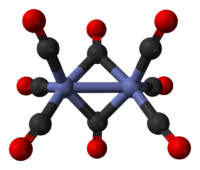
分子構造
オクタカルボニル二コバルトには構造異性体が存在する[4]。よく知られた2例は下式のような構造式で表される。

結晶中では右側の、2個のカルボニル配位子が2個のコバルトをμ-架橋した C2v 対称構造 ((CO)3Co(μ-CO)2Co(CO)3) が優勢であり、そこでは Co-Co 結合の距離は 2.522-2.525 Å、架橋カルボニルとコバルトの距離 Co-CObridge は 1.883-1.949 Å、末端カルボニルとコバルトとの距離 Co-COterminal は 1.770-1.818 Å と報告されている[5]。この構造は Fe2(CO)9 と似ており、比べるとカルボニル架橋が1個少ないだけである。液相では式の左側の非架橋型との異性化が起こる。非架橋型 ((CO)4Co-Co(CO)4) はD3d 対称性を持つ。
反応
オクタカルボニル二コバルトは水素と反応して単核のヒドリド錯体へと分解する。
- Co2(CO)8+H2⟶2HCo(CO)4{displaystyle {ce {{Co2(CO)8}+ H2 -> 2HCo(CO)4}}}
このヒドリド錯体はヒドロホルミル化の活性種であり、アルケンに付加するとアルキルCo(CO)4 中間体を与え、それからカルボニルが C-Co 結合に挿入、水素化を受けアルデヒドとなる。
カルボニルのいくつかを三級ホスフィンで置き換えた Co2(CO)8−x(PR3)x{displaystyle {{ce {Co2(CO)_{8-x}(PR3)_{x}}}}}
アルカリ金属で還元するとアニオン種が発生する。これは上のヒドリド錯体の共役塩基に相当する。
- Co2(CO)8+2Na⟶2NaCo(CO)4{displaystyle {ce {{Co2(CO)8}+ 2Na -> 2NaCo(CO)4}}}
オクタカルボニル二コバルトはアルキンと強い付加体を作り活性化させる。その性質を利用して、アルキンとアルケンと一酸化炭素を縮合させてシクロペンテノン環を得るポーソン・カンド反応や、プロパルギルアルコールのヒドロキシ基を求核剤と置き換えるニコラス反応の試薬として利用される。
ピリジンなどルイス塩基の作用でオクタカルボニル二コバルトは分解する。
- 6pyridine+32Co2(CO)8⟶ [Co(pyridine)6][Co(CO)4]2+4CO{displaystyle {ce {{6{mathit {pyridine}}}+3/2Co2(CO)8-> {[Co({mathit {pyridine}})6][Co(CO)4]2}+4CO}}}
加熱すると一酸化炭素を放出しながら四面体型のクラスター Co4(CO)12{displaystyle {{ce {Co4(CO)12}}}}
安全性
オクタカルボニル二コバルト自身は揮発性を持ち、また、分解すると一酸化炭素を発生させる。反応性の高さから空気中では発火の危険性がある。通常は暗所で冷蔵保存される。
参考文献
^ Pauson, P. L. "Octacarbonyldicobalt" in Encyclopedia of Reagents for Organic Synthesis, Paquette, L. ed., J. Wiley & Sons, New York, 2004. DOI: 10.1002/047084289
^ Elschenbroich, C.; Salzer, A. ”Organometallics : A Concise Introduction” (2nd Ed) (1992) Wiley-VCH: Weinheim. ISBN 3-527-28165-7
^ Wender, I.; Sternberg, H. W.; Metlin, S.; Orchin, M. Inorg. Synth. 1957, 5, 190.
^ Sweany, R. L.; Brown, T. L. "Infrared spectra of matrix-isolated dicobalt octacarbonyl. Evidence for the third isomer" Inorg. Chem 1977, 16, 415-421. DOI: 10.1021/ic50168a037
^ Sumner, G. G.; Klug, H. P.; Alexander, L. E. "The crystal structure of dicobalt octacarbonyl" Acta Crystallographica 1964, 17, 732-742. DOI: 10.1107/S0365110X64001803
| ||||||||





![{displaystyle {ce {{6{mathit {pyridine}}}+3/2Co2(CO)8-> {[Co({mathit {pyridine}})6][Co(CO)4]2}+4CO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3d0f063de8479503d1ca96446b8685666d6aa00d)