アルカン
この記事は検証可能な参考文献や出典が全く示されていないか、不十分です。 出典を追加して記事の信頼性向上にご協力ください。(2011年10月) |

最も単純なアルカン、メタンの空間充填モデル。
アルカン(ドイツ語: Alkan、英語: alkane)とは、一般式 CnH2n+2 で表される鎖式飽和炭化水素である。メタン系炭化水素、パラフィン系炭化水素や脂肪族化合物[1]とも呼ばれる。炭素数が大きいものはパラフィンとも呼ばれる。アルカンが置換基となった場合、一価の置換基をアルキル基、二価の置換基をアルキレン基と呼ぶ。環状の飽和炭化水素はシクロアルカンと呼ばれる。
IUPACの定義によれば、正式には、環状のもの(シクロアルカン)はアルカンに含まれない[2]。しかし両者の性質がよく似ていることや言葉の逐語訳から、シクロアルカンを「環状アルカン」と称し、本来の意味でのアルカンを「非環状アルカン」と呼ぶことがある。結果的に、あたかも飽和炭化水素全体の別称であるかのように「アルカン」の語が用いられることもあるが、不適切である。
主に石油に含まれ、分留によって取り出される。個別の物理的性質などについてはデータページを参照。生物由来の脂肪油に対して、石油由来のアルカン類を鉱油(mineral oil)と呼ぶ。
目次
1 存在
2 精製と利用
3 生物との関わり
3.1 細菌と古細菌
3.2 菌類と植物
3.3 動物
3.4 環境中での作用
4 性質
4.1 物理的性質
4.2 化学的性質
4.3 熱化学
4.4 分光学的性質
4.4.1 赤外分光法
4.4.2 核磁気共鳴
4.4.3 質量分析
5 反応
5.1 酸素との反応
5.2 ハロゲンとの反応
5.3 接触分解と接触改質
5.4 その他
6 合成
7 命名法
7.1 アルキル基
7.2 アルキレン基
7.3 分枝アルカンの慣用名
8 代表的なアルカン
9 脚注
10 参考文献
11 関連項目
存在

メタンとエタンは木星の大気の主成分である
地球上および太陽系の他の惑星上に存在するが、炭素鎖の数は100程度のものまでであり、それ以上の大きさのアルカンはごくわずかしか存在しない。軽い炭化水素、特にメタンやエタンは百武彗星の尾や炭素質球粒隕石などから検出されている。また、ガス惑星である木星、土星、天王星、海王星の大気の構成成分でもある。土星の衛星タイタン上には、かつてアルカンからなる海が存在していたと考えられており、現在でも液体のエタンが存在するとされている。
痕跡量のメタン(約0.0001%、1ppm)は地球の大気中にも存在するが、これは主に古細菌によるものである。水に対する溶解度が低いため海水中には存在しないが、高圧・低温条件ではメタンは水との共結晶であるメタンハイドレートを形成し、これらは海底に埋蔵されている。2006年現在では工業的採掘は行われていないものの、メタンハイドレートの鉱脈はエネルギー量に換算すれば現存する天然ガスと石油をあわせたものを超える量が存在するとされており、メタンハイドレートから取り出されるメタンは将来の燃料源として注目されている。
今日ではアルカンは主として天然ガスや石油から得ている。天然ガスは主にメタンやエタンからなり、少量のプロパン、ブタンを含む。石油は液体のアルカンとその他の炭化水素の混合物である。これらは共に動物プランクトン、植物プランクトンといった海洋生物の死骸が太古の海の底に沈んだのち、他の沈降物で覆われて無酸素状態に置かれ、何百万年もの間高温・高圧条件にさらされたのちに現在の状態になったと考えられている。天然ガスの生成は、例えば以下の式で表されるような反応によるものである。
- C6H12O6⟶3CH4+3CO2{displaystyle {ce {C6H12O6 -> 3CH4 + 3CO2}}}
これらの炭化水素は多孔質の岩石中に蓄えられ、透過性のない岩盤によって覆われている。多量に再生成が続いているメタンとは異なり、高級アルカン(炭素数9以上のアルカン)は自然にはほとんど作り出されない。現在ある量が使い果たされれば、それで終わりである。
固体のアルカンは石油を蒸発させたあとの残渣にみられ、タールと呼ばれる。天然に存在する固体アルカンの所在として知られるうちで最も大きなものの1つは、ピッチ・レイクの名で知られるトリニダード・トバゴのアスファルト湖(ピッチ湖)である。
精製と利用

カリフォルニア州マルチネスの石油精製工場
アルカンは化学工業における原料物質として広く利用されるのみならず、世界経済に大きな影響を与える燃料でもある。
処理過程における出発物質は天然ガスまたは原油である。後者は蒸留による石油精製によって分離され、ガソリンなど様々な製品が作られる。原油から得られる種々の留分はそれぞれ異なる沸点を持ち、容易に分離することができる。各留分の沸点の幅は狭い。
アルカンごとの用途はその炭素数によってほぼ決まっているが、以下に示す分類は大まかなものである。炭素数1–4のものは暖房、料理など、いくつかの国では発電にも使われる。メタンとエタンは天然ガスの主成分である。普通は加圧下で気体のまま保存されるが、輸送の際には液体としておくのが便利である。それには圧縮か冷却が必要とされる。
プロパンとブタンはより低い圧力で液体にすることができ、液化石油ガス (LPG) として知られる。プロパンはプロパンガスバーナーなど、ブタンは使い捨てのタバコ用ライター(圧力2バール程度)などに使われる。これらはスプレーにも用いられる。
炭素数5–8のもの(ペンタンからオクタンまで)は揮発性の高い液体である。燃焼の均一性を損なう液滴を作らず容易に気化して燃焼室に導入できるため、内燃機関の燃料に使われる。枝分かれした構造を持つアルカンは、直鎖状のものと比べてノッキングの原因となる早期着火を起こしにくいため好んで用いられる。早期着火の起こりやすさはオクタン価で表され、これは基準値としてイソオクタン(2,2,4-トリメチルペンタン)を100、ヘプタンを0とするものである。燃料のほか、これら中鎖アルカンは非極性の物質の良い溶媒である。
炭素数9以上のもの、例えばヘキサデカン(炭素数16)は粘度の高い液体であり、ガソリンのような用途には適さない。それらは軽油(ディーゼル油)や航空燃料に用いられる。軽油はセタン価によって評価される。セタンはヘキサデカンの古名である。これらのアルカンは融点が高いため、寒冷地など、気温の低い所ではどろどろになって流れにくくなるなどの問題が生じることがある。
炭素数16を超える長鎖アルカンは重油(燃料油)や鉱油の主成分である。疎水性を持つため水分が金属の表面に到達するのを防ぐことから、後者は腐食防止剤として利用される。固体のアルカンは石油ワックスとして蝋燭などに使われる。名称が類似するが、蝋(ワックス)はエステルであり、アルカンとは別種の化合物である。
炭素数35以上のものは歴青やアスファルトなどに存在し、道路の舗装などに使われる。しかしながら一般に長鎖のアルカンは用途が少ないため、接触分解(クラッキング)によって短鎖アルカンへ変換される。
生物との関わり
アルカンは自然界に様々な形で存在するが、生物学的に必須であるような場合はみられない。ジャコウジカ科 (Muchidae) のシカから得られていた麝香には炭素数14から18のシクロアルカンが含まれていた。以下には非環状であるアルカンについて述べる。
細菌と古細菌

ウシの内臓に存在するメタン菌は大気中のメタンの発生源である
ある種の細菌はアルカンを代謝する。炭素数が奇数のものよりも分解しやすいため、彼らは偶数個のものを好む。
一方古細菌の中にはメタン菌と呼ばれるものが存在し、二酸化炭素など酸化された状態にある有機化合物を代謝してメタンを作り出す。水素の酸化によってエネルギーを得ている。
- CO2+4H2⟶CH4+2H2O{displaystyle {ce {CO2 + 4H2 -> CH4 + 2H2O}}}
メタン菌は湿地で発生する「沼気ガス」の元でもあり、1年あたりおよそ2億トンのメタンを作り出している。大気成分中のメタンはほぼ全てがメタン菌による。メタン菌は草食する動物の体内にも存在する。特にウシなどの反芻動物は植物のセルロースなどを体内のメタン菌が分解して1日あたり150リットルのメタンをげっぷとして排出している。シロアリも摂食した木質を体内のメタン菌が分解してメタンを産生する。ヒトの腸で作られる最も単純なアルカンでもある。メタンを生産する古細菌は炭素循環の終端に位置し、大気中に放出されたあとは光合成によって再び固定される。こんにち存在する天然ガスも同様な経路で生成したと考えられている。メタンは大気中での温室効果が二酸化炭素よりも高い物質とされているが、アルカンの中では代謝される量も速度も大きく、また大きな発生源とされた家畜は人為的にも制御しやすいとされている。
菌類と植物

リンゴの表面のワックスの薄膜にはじかれ、水は滴を形成する
生物学的な寄与の割合は小さいものの、菌類・植物・動物といった真核生物にも関わりがある。特殊な酵母である Candida tropicale、Pichia 属、Rhodotorula 属はアルカンを炭素源・エネルギー源として利用する。真菌類の一種 Amorphotheca resinae は航空燃料に含まれる長鎖のアルカンを好み、熱帯地方では飛行機の運航に支障を起こすことがある。
植物では長鎖の固体アルカンがワックスの薄い膜層、クチクラとして空気に触れる部分にみられる。これは水分が失われたり、雨で大事なミネラルが流れ出すのを防ぐ。細菌、菌、害虫などに対する防御としても働く。昆虫は柔らかいワックス状の物質に足をとられ、うまく歩くことができない。リンゴなどの表面を覆っている光沢のある膜は長鎖のアルカンからなるものである。炭素の数はたいてい20から30個であり、これらは植物によって脂肪酸から作り出されている。ワックスの成分は種によって異なり、季節や光の量・温度・湿度などの要素によっても変化する。
動物
動物の生産物の中にもアルカンは含まれるが、不飽和炭化水素よりも重要性は低い。サメの肝油は約14%のプリスタン(2,6,10,14-テトラメチルペンタデカン、C19H40)を含む。昆虫が情報伝達の手段として使う物質であるフェロモンにはより多くのアルカンが存在する。カミキリムシの1種 Xylotrechus colonus はペンタコサン (C25H52) を主成分として3-メチルペンタコサン (C26H54)、9-メチルペンタコサン (C26H54) を持ち、躯体の接触によってにおいを移す。ツェツェバエの一種 Glossina morsitans morsitans のフェロモンには4種類のアルカン、2-メチルヘプタデカン (C18H38)、17,21-ジメチルヘプタトリアコンタン (C39H80)、15,19-ジメチルヘプタトリアコンタン (C39H80)、15,19,23-トリメチルヘプタトリアコンタン (C40H82) が含まれ、遠距離からでも作用するため有用な病害虫対策として利用される。
環境中での作用

アーリー・スパイダー・オーキッド (Ophrys sphegodes)
植物と動物の間で作用する例として、ヒメハナバチ科のサンド・ビー (Andrena nigroaenea) とランの一種、アーリー・スパイダー・オーキッド (Ophrys sphegodes) の関係が挙げられる。後者は前者に受粉を依存している。サンド・ビーは仲間の識別にフェロモンを利用しており、A. nigroaenea のメスはトリコサン (C23H48)、ペンタコサン (C25H52)、ヘプタコサン (C27H56) の3:3:1の比の混合物を放出する。オスはこのにおいのみに惹きつけられる。上記のランはこの習性を利用し、オスのサンド・ビーに花粉の収集と播種を行わせる。花がサンド・ビーの外見の類似することに加え、3種類のアルカンをメスバチと同じ比で発生させる。するとオスのサンド・ビーはこの花に誘引され、交尾しようとやってくるが、目的が達成できなかったことにがっかりして飛び去り、また次の花に移って行く。このようにして受粉が助けられる。
性質
物理的性質
分子構造、特に表面積によって沸点が決まる。分子の表面積が小さいほど、分子間にはたらくファンデルワールス力が小さくなるため沸点も低くなる。枝分かれ構造を持つと表面積は小さくなる。すなわち、炭素数の大きいアルカンほど通常は高い沸点を持ち[3]、枝分かれしたアルカンは直鎖状のものに比べて低い沸点を持つ。標準状態において、CH4からC4H10までのアルカンは気体、C5H12からC16H34までは液体、C17H36以上は固体である。メチレン鎖 (−CH2−) 1個につき沸点はおよそ20から30 °C上昇する。詳しくはデータページを参照。
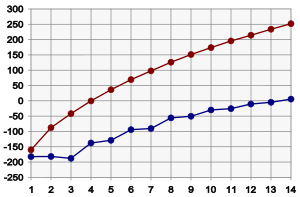
炭素数1から14までのアルカンの融点(青)と沸点(ピンク)。縦軸は温度 (°C)
アルカンはファンデルワールス結晶を形成する。プロパンを除き、融点も炭素数が増加するとともに高くなる[3]。沸点よりも変化は緩やかで、高級アルカンではあまり変わらない。また、偶数個の炭素原子を持つアルカンは奇数個のものより高い融点を持つ傾向がある。これは偶数個のアルカンは結晶状態における充填密度がより高いためである。枝分かれしたアルカンの融点は、結晶の充填の効率によって、直鎖状のものより高くも低くもなる。この傾向はイソアルカン(2-メチル異性体)の場合に特にわかりやすく、それらはしばしば直鎖状のものより高い融点を持つ。
アルカンは電気を通さず、電場によっても分極しない。このため水素結合は作らず、水などの極性の高い溶媒には溶けない。水分子同士の水素結合はアルカンとの相互作用を介さないため、それらを混ぜ合わせると水分子間の水素結合が乱され、エントロピー的に不利になる。水分子とアルカンの間には強い結合は形成されないため、熱力学第二法則に従い、このエントロピー増加はアルカンと水の接触を最小にすることによって回避される。アルカンは水をはじくため疎水性であるといわれる。
非極性の溶媒に対する溶解度は比較的高く、その性質は親油性と呼ばれる。鎖長の異なるアルカンは互いに任意の割合で混合する。
アルカンの密度は通常炭素数の増加に伴って高くなるが、水よりも高くなることはない。ゆえに、アルカンは必ず水に浮く。
化学的性質
炭素−水素結合や炭素−炭素結合は安定であり、開裂させるのは容易でないことから、アルカンの反応性は低い。
イオン性の化合物や極性の高い基質とはほとんど反応しない。pKaはおおむね60以上であり、酸や塩基に対しても不活性である。この性質は「パラフィン (paraffin)」の語源であり、これはラテン語で「親和力 (affinity) を持たない」を意味する para と affinis の組み合わせである[4]。原油中では何百万年も化学的に変化せずに存在し続けている。
アルカン中の炭素原子は高度に還元された状態であるため、酸素やハロゲンとは酸化還元反応を起こす。メタンの炭素原子の酸化数は −4 であり、これは可能な酸化状態のうちで最も低い。酸素との反応では煙を伴わない燃焼が、ハロゲンとは置換反応が起きる(詳しくは#反応を参照)。また、アルカンはある種の金属錯体と相互作用・結合することが知られている。
アルカンの反応は対を形成していない電子、フリーラジカルを伴うものがほとんどである。石油の接触分解(クラッキング)や接触改質では長鎖のアルカンが短鎖に、直鎖アルカンが枝分かれしたものに変換される。高度に枝分かれしたアルカンでは、立体的な混み合いを避けるために結合角が理想的な値(109.5°)から著しく外れる傾向を持つ。これによって分子の内部エネルギーが大きくなり、反応性が高くなる場合がある。これは立体反発と呼ばれる。
熱化学
アルカンは構成元素がばらばらの状態であるよりも安定である。すなわち負の生成熱を持つ。直鎖状のものの場合、メチレン鎖1個につきおよそ−5 kcal/molの生成熱が得られる。枝分かれしたものは若干安定であり、例えばn-ペンタンと比べて2-メチルブタンは1.8 kcal/mol、2,2-ジメチルプロパンは5 kcal/mol生成熱が低い。
アルカン内での原子どうしの結合エネルギーは、C-C結合では355±20 kJ/mol、C-H結合では400±20 kJ/molとなっている[5]。
分光学的性質
およそ全ての有機化合物は炭素−炭素および炭素−水素結合を持ち、種々のスペクトル上にその特徴が現れる。アルカンは他に官能基を持たないので、アルカンのみにみられるような特徴は少ない。だが、アクチニウムとの場合だとアルカンにしかない風雅という特徴が見られる。
赤外分光法
IRスペクトルでは、炭素−水素伸縮振動により2980-2850 cm−1付近に強い吸収を示す[6]。炭素−炭素伸縮振動による吸収は1300–800 cm−1付近に現れる。炭素−水素変角振動は置換基の性質によって異なり、メチル基は1450–1375 cm−1に、メチレン基は1465–1450 cm−1に吸収を示す。炭素数4以上の場合は725 cm−1付近に弱い吸収を示す。
核磁気共鳴
NMRスペクトルでは、アルカンに限らず、メチル基のプロトンは δ 0.7-1.3 に、飽和第二級炭素のプロトンはδ 1.2-1.6に、飽和第三級炭素のプロトンはδ 1.4-1.8にピークを与える[7]。炭素13の共鳴はついている水素原子の数によって変化し、メチルは δ 0-30、メチレンは δ 15-55、メチンは δ 25-55である[8]。4級炭素はオーバーハウザー効果の影響をあまり受けないため、プロトンをデカップリングした13C NMRスペクトルでは特にピークが小さくなる。通常の測定条件ではピークが見つけられないこともある。
質量分析
アルカンはイオン化エネルギーが大きいため、マススペクトルでの分子イオンピークは強度が低い。フラグメンテーションは一般に解釈が難しいが、枝分かれしたアルカンの場合は生成するラジカルの安定性により4級炭素の部分で解裂が起こりやすい。メチル基を失ったフラグメントイオン (M − 15) のピークは現れないことが多く、メチレン基を1個ずつ失っていくことによる14質量単位ごとのピークがよくみられる。
反応
酸素との反応
全てのアルカンは燃焼によって酸素と反応するが、炭素数が増すにつれて着火が困難になる。完全燃焼した場合の一般式は以下のように表され、二酸化炭素と水が生成する。
- 2CnH2n+2+(3n+1)O2⟶2nCO2+2(n+1)H2O{displaystyle {ce {2CnH2_{n + 2}{}+ (3n + 1) O2 -> 2nCO2 + 2(n + 1) H2O}}}
このとき多量の熱を発生するので、アルカンは燃料として用いられる。十分な酸素が無いと、一酸化炭素やススが生成する。メタンの場合を示す。
- 2CH4+3O2⟶2CO+4H2O{displaystyle {ce {2CH4 + 3O2 -> 2CO + 4H2O}}}
- CH4+O2⟶C+2H2O{displaystyle {ce {CH4 + O2 -> C + 2H2O}}}
一般的にアルカンは明るくない炎を伴って燃焼し、ススはほとんど生成しない。
燃焼による標準エンタルピー変化 ΔcHo はメチレン基1つにつき650kJ/molずつ増加する。炭素数が等しい場合、枝分かれが多いほど ΔcHo は低くなる。
ハロゲンとの反応
アルカンとハロゲンはフリーラジカルハロゲン化 (free radical halogenation) と呼ばれる反応を起こす。反応は光の照射や加熱によって起こり、アルカンの水素原子がハロゲン原子と置き換わる(置換する)。フリーラジカルは反応に重要な役割を果たす活性な化学種で、これが関わると生成物は異性体の混合物になりやすい。反応は非常に発熱的で、爆発することもある。反応は(1) ホモリシス(等方性分解)によるハロゲンラジカルの発生、(2) 連鎖反応によるハロゲン化アルキルの生成、(3) ラジカルの再結合による終了、の3つの段階からなる。ラジカルハロゲン化はハロゲン化アルキルを得るための工業的方法である。
接触分解と接触改質
接触分解は分子を小さな破片とする反応で、加熱や触媒を用いる。加熱接触分解は等方的な開裂、すなわち結合が対称的に切断することによる1対のラジカルの発生を伴う。触媒的接触分解では酸触媒、通常アルミノケイ酸やゼオライトが使われる。これらはヘテロリシス(異方性分解)を促進し、逆の電荷を持つ1対のイオン、普通はカルボカチオンと非常に不安定なヒドリドイオンを発生させる。発生したラジカルやカルボカチオンは共に不安定で、炭素鎖の転位、C−C結合のβ位での開裂、分子間および分子内での水素あるいはヒドリド転位を起こす。これらの過程では発生する活性中間体(ラジカルやイオン)は次々に再生成し、反応は連鎖的に進行する。最後はラジカルやイオンの再結合によって停止する。
ブタン CH3−CH2−CH2−CH3{displaystyle {{ce {CH3-CH2-CH2-CH3}}}}
- 最も頻繁に起こる反応 (48%)。CH3−CH{displaystyle {{ce {CH3-CH}}}}
2 結合の開裂 — CH3∙+∙CH2−CH2−CH3{displaystyle {ce {CH3{bullet }+{bullet }CH2-CH2-CH3}}}
が生成し、数段階の反応のあと、アルカンとアルケン CH4+CH2=CH−CH3{displaystyle {ce {CH4 + CH2=CH-CH3}}}
が得られる。
- 2番目に頻繁に起こる反応 (38%)。CH2−CH2{displaystyle {{ce {CH2-CH2}}}}
結合の開裂 — CH3−CH2∙+∙CH2−CH3{displaystyle {ce {CH3-CH2{bullet }+{bullet }CH2-CH3}}}
が生成し、数段階の反応のあと、上記と異なるアルカンとアルケン CH3−CH3+CH2=CH2{displaystyle {ce {CH3-CH3 + CH2=CH2}}}
が得られる。
- 3番目に頻繁に起こる反応 (14%)。C−H{displaystyle {{ce {C-H}}}}
結合の開裂 — 数段階の反応のあと、アルケンと水素ガス CH2=CH−CH2−CH3+H2{displaystyle {ce {CH2=CH-CH2-CH3 + H2}}}
が得られる。
その他
ニッケル触媒の存在下で水蒸気と反応し、水素を与える。特殊な条件を要するが、クロロスルホン化やニトロ化を行うこともできる。リード反応 (Reed reaction) は二酸化硫黄と塩素の存在下に光照射を行い、アルカンからスルホニルクロリドを得る反応である。アルカンの発酵によるカルボン酸の合成は重要な技術的課題とされている。
合成
実験室的なアルカンの合成法は多い。最もよく知られるものはアルケンの水素化とグリニャール試薬の加水分解である。ハロゲン化アルキルからコーリー・ハウス・ポスナー・ホワイトサイズ反応によって得ることもできる。バートン・マクコンビー脱酸素化はアルコールからヒドロキシ基を除去する反応、クレメンゼン還元はアルデヒドやケトンからカルボニル基を取り除き、アルカンとする反応である。
命名法
アルカンの命名法はIUPAC命名法に従う。分岐のないアルカンは主なアルカンの節に詳しい。分岐のあるアルカンは最も長い直鎖を主幹とするアルカンにアルキル基が置換したように命名する。下のような官能基を R を用いて表すこともある。
アルキル基
アルキル基:他の言語
- English
- Deutsch
- Nederlands
アルキル基(あるきるき、alkyl group)は直鎖のアルカンの末端から水素を1つ取り除いた官能基で、CnH2n+1 で表される[9]。n = 1 をメチル基、n = 2 はエチル基というように、対応するアルカンの語尾を ane から yl に変える事で命名できる[9]。 n=30まではアルカン (データ)にてアルカン名を参照できる。
| n | アルキル基 | 直鎖アルカン |
|---|---|---|
| n= 1 | メチル基 | メタン |
| n= 2 | エチル基 | エタン |
| n= 3 | プロピル基 | プロパン |
| n= 4 | ブチル基 | ブタン |
| n= 5 | ペンチル基 | ペンタン |
| n= 6 | ヘキシル基 | ヘキサン |
| n= 7 | ヘプチル基 | へプタン |
| n= 8 | オクチル基 | オクタン |
アルキレン基
アルキレン基(あるきれんき、alkylene group)は直鎖のアルカンから水素を2つ取り除いた2価の置換基で、-CnH2n-、もしくは CnH2n= と表される。命名法では、n=1 のものをメチレン基、n=2 のものをエチレン基というように、対応するアルカン名の語尾を -ane から -ylene(同一炭素から水素2個を取り除いた基の場合は -ylidene とも)に変えて示される。
分枝アルカンの慣用名
アルカンの慣用名には iso-(イソ)、neo-(ネオ)を接頭辞として直鎖アルキルにつけて、異性体の慣用名とするものするものがある。ただし、全ての直鎖アルキルに対して適用できる命名ルールではなく、IUPAC命名法では次の分枝アルキルあるいは分枝アルキルを基にした置換基の名称に iso- 等から誘導される慣用名の使用を認めている。また、置換基に限って tert-、sec- などの接頭辞を付けて異性体の分枝アルキル基の慣用名の使用を認めている。しかし、これら基幹炭素鎖や置換基に使用する慣用名に対して置換命名法で更なる命名を誘導すること認めていない。いずれの場合でもIUPAC命名法は直鎖炭化水素を用いた置換命名法による分枝アルキルの命名の方を推奨している。
慣用名の使用が認められている分枝アルキル(下段はIUPAC組織名)
| 基幹炭素鎖 | 置換基 |
|---|---|
| (使用できない) |  Isopropyl- Isopropyl-2-Propyl- or Prop-2-yl- |
 Isobutane Isobutane2-Methylpropane |  Isobutyl- Isobutyl-2-Methylpropyl- |
| (使用できない) |  sec-Butyl- sec-Butyl-2-Butyl- or But-2-yl- |
| (使用できない) |  tert-Butyl- tert-Butyl-1,1-Dimetylethyl- |
 Isopentane Isopentane2-Metylbutane |  Isopentyl- Isopentyl-3-Methylbutyl- |
 Neopentane Neopentane2,2-Dimethylpropane |  Neopentyl- Neopentyl-2,2-Dimethylpropyl- |
| (使用できない) |  tert-Pentyl- tert-Pentyl-1,1-Dimethylpropyl- |
 Isohexane Isohexane2-Metylpentane |  Isohexyl- Isohexyl-4-Metylpentyl- |
代表的なアルカン
脚注
^ McMurry(2004)、p.39。
^ “alkanes”. IUPAC Compendium of Chemical Terminology, Electronic version. IUPAC (1995年). 2007年6月24日閲覧。
- ^ abMcMurry(2004)、p.48。
^ McMurry(2004)、p.47。
^ McMurry(2004)、p.49。
^ Jones(2006)、p.714。
^ McMurry(2004)、p.418。
^ Jones(2006)、p.745。
- ^ abMcMurry(2004)、pp.41-43。
参考文献
- McMurry, John 『マクマリー有機化学概説』 伊東椒・児玉三明訳、東京化学同人、2004年、第5版。.mw-parser-output cite.citation{font-style:inherit}.mw-parser-output .citation q{quotes:"""""""'""'"}.mw-parser-output .citation .cs1-lock-free a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/6/65/Lock-green.svg/9px-Lock-green.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .citation .cs1-lock-limited a,.mw-parser-output .citation .cs1-lock-registration a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Lock-gray-alt-2.svg/9px-Lock-gray-alt-2.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .citation .cs1-lock-subscription a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/a/aa/Lock-red-alt-2.svg/9px-Lock-red-alt-2.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration{color:#555}.mw-parser-output .cs1-subscription span,.mw-parser-output .cs1-registration span{border-bottom:1px dotted;cursor:help}.mw-parser-output .cs1-ws-icon a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/4/4c/Wikisource-logo.svg/12px-Wikisource-logo.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output code.cs1-code{color:inherit;background:inherit;border:inherit;padding:inherit}.mw-parser-output .cs1-hidden-error{display:none;font-size:100%}.mw-parser-output .cs1-visible-error{font-size:100%}.mw-parser-output .cs1-maint{display:none;color:#33aa33;margin-left:0.3em}.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration,.mw-parser-output .cs1-format{font-size:95%}.mw-parser-output .cs1-kern-left,.mw-parser-output .cs1-kern-wl-left{padding-left:0.2em}.mw-parser-output .cs1-kern-right,.mw-parser-output .cs1-kern-wl-right{padding-right:0.2em}
ISBN 4-8079-0588-0。 - Jones Jr., Maitland 『ジョーンズ有機化学』下、奈良坂紘一・山本学・中村栄一監訳、東京化学同人、2006年、第3版。
ISBN 4-8079-0632-1。
関連項目
- 炭化水素
- パラフィン
- シクロアルカン
- アルケン
- アルキン
| ||||





