スルファミン酸
| スルファミン酸 | |
|---|---|
 | |
 |  |
IUPAC名 スルファミン酸 | |
別称 アミド硫酸 | |
| 識別情報 | |
CAS登録番号 | 5329-14-6 |
日化辞番号 | J43.594E |
EC番号 | 226-218-8 |
国連/北米番号 | |
RTECS番号 | WO5950000 |
| 特性 | |
化学式 | H3NSO3 |
モル質量 | 97.10 g mol−1 |
示性式 | H3N+SO3− |
| 外観 | 無色結晶 |
密度 | 2.15 g cm−3, 固体 |
融点 | 分解 |
水への溶解度 | 14.689g / 100g (0 °C) |
酸解離定数 pKa | 0.99 |
| 熱化学 | |
標準生成熱 ΔfH | −674.9 kJ mol−1 |
| 危険性 | |
安全データシート(外部リンク) | ICSC 0328 |
| EU Index | 016-026-00-0 |
Rフレーズ | R36/38 R52/53 |
Sフレーズ | S2 S26 S28 S61 |
引火点 | 不燃性 |
| 関連する物質 | |
| 関連物質 | カルバミン酸 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
スルファミン酸(スルファミンさん、英: sulfamic acid)は、硫酸のヒドロキシ基がアミノ基に置換したもの。無色の固体。別名はアミド硫酸。
水によく溶け、比較的強い酸性を示す。固体を加熱すると 205 ℃で分解する[1]。ジアゾ染料で染色した際に残留している余剰亜硝酸塩を分解するのに使用される。
目次
1 構造と反応性
2 製法
3 反応
4 利用
5 出典
6 参考文献
7 外部リンク
構造と反応性
スルファミン酸の構造は、硫酸 HOSO2(OH) のヒドロキシ基がアミノ基に置換した中性型 H2NSO2(OH) ではなく、互変異性体である双性イオン型のひとつ、H3N+SO3− で表される。結晶中では3個の水素がすべて窒素から 1.03 Å の距離にあることが中性子回折法により示されている。これより、4種類の異性体(中性型 H2NSO2(OH)、HN=SO(OH)2、双性イオン型 H3N+SO3−、H2N+=SO(OH)O−)のうち、H3N+SO3− の構造が主であることが分かった[2]。また、硫黄と酸素、硫黄と窒素の結合距離はそれぞれ 1.44、1.77 Å であり、長い硫黄-窒素は単結合性を、短い硫黄-酸素は二重結合性を持つことを示している[3]。
スルファミン酸は比較的強酸で、酸解離定数は Ka = 1.01 x 10−1 である。固体は吸湿性を示さず純品を得やすいため、酸塩基滴定で標準物質として用いられる。液体アンモニアの中では2段階の脱プロトン化を受け、ジアニオン [HNSO3]2− となる[4]。
アミノ基が電子求引基と結合している点で尿素と共通点がある。例えば水溶液を加熱すると、ともにアンモニウムイオンを生成する。
製法
尿素と発煙硫酸の反応によって生じる[1]。
- CO(NH2)2+H2S2O7⟶2(NH2)HSO3+CO2{displaystyle {ce {{CO(NH2)2}+ H2S2O7 -> 2{(NH2)HSO3}+ CO2}}}
反応
亜硝酸と反応して窒素ガスを発生する。
- HNO2+(NH2)HSO3⟶H2SO4+N2+H2O{displaystyle {ce {{HNO2}+ (NH2)HSO3 -> {H2SO4}+ {N2}+ H2O}}}
水酸化ナトリウム溶液の正確な濃度を求めるための標定に用いられる。
- (NH2)HSO3+NaOH⟶(NH2)NaSO3+H2O{displaystyle {ce {{(NH2)HSO3}+ NaOH -> {(NH2)NaSO3}+ H2O}}}
還元剤としてはたらき硝酸と反応して亜酸化窒素が発生する。
- HNO3+(NH2)HSO3⟶H2SO4+N2O+H2O{displaystyle {ce {{HNO3}+ (NH2)HSO3 -> {H2SO4}+ {N2O}+ H2O}}}
冷水中では徐々に、80℃以上では速やかに加水分解して、硫酸水素アンモニウムになる。
- (NH2)HSO3+H2O→80∘CNH4HSO4{displaystyle {ce {{(NH2)HSO3}+H2O->[80,^{circ }{text{C}}]{NH4HSO4}}}}
利用
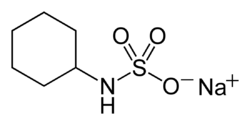
チクロ
スルファミン酸は人工甘味料との関連が深い。スルファミン酸とシクロヘキシルアミンの混合物に水酸化ナトリウムを反応させて得られるチクロはかつて安価な甘味料として多用されていた。現在も使われるアセスルファムカリウムもまたスルファミン酸構造を持つ人工甘味料の例である。
スルファミン酸の O-または N-置換誘導体の中には、抗生物質、HIVに対する逆転写阻害薬やプロテアーゼ阻害薬、抗ガン剤(ステロイドサルファターゼ阻害薬、炭酸脱水酵素阻害薬)、抗てんかん薬、あるいは抗肥満薬として用いられるものがある。
スルファミン酸は酸性の洗浄剤として、金属やセラミックの洗浄に用いられる。塩酸の代わりに錆落とし、湯垢落としとして用いられる。
ほか、エステル化反応やポリマー(ウレタン樹脂、入れ歯安定剤)の固化を進める酸触媒、色素や除草剤合成の原料、亜硝酸製造、水系消火剤への添加剤としての用途が知られる。
出典
- ^ ab『新実験化学講座』 pp. 342-343.
^ R. L. Sass (April 1960). “A neutron diffraction study on the crystal structure of sulfamic acid”. Acta Crystallographica 13 (4): 320–324. doi:10.1107/S0365110X60000789.
^ J. W. Bats, P. Coppens, T. F. Koetzle (1977). “The Experimental Charge Density in Sulfur-Containing Molecules: A Study of the Deformation Electron Density in Sulfamic Acid at 78 K by X-ray and Neutron Diffraction”. Acta Crystallographica B33. doi:10.1107/S0567740877002568.
^ Clapp, L. B. (1943). “Sulfamic acid and its uses”. Journal of Chemical Education 20 (4): 189–346. doi:10.1021/ed020p189.
参考文献
- MSDS
- 総説: "Sulfamates and their therapeutic potential." Med. Res. Rev. 2005, 25, 186-228.
- 総説: R. J. Cremlyn "An Introduction to Organosulfur Chemistry" John Wiley and Sons: Chichester, 1996. ISBN 0-471-95512-4
- 総説: Greenwood, N. N.; Earnshaw, A. "Chemistry of the Elements, 2nd Edition" Oxford: Butterworth-Heinemann, 1997. ISBN 0-7506-3365-4
- 『無機化合物の合成』I、日本化学会、丸善出版〈新実験化学講座 8-I〉、1976年。.mw-parser-output cite.citation{font-style:inherit}.mw-parser-output .citation q{quotes:"""""""'""'"}.mw-parser-output .citation .cs1-lock-free a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/6/65/Lock-green.svg/9px-Lock-green.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .citation .cs1-lock-limited a,.mw-parser-output .citation .cs1-lock-registration a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Lock-gray-alt-2.svg/9px-Lock-gray-alt-2.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .citation .cs1-lock-subscription a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/a/aa/Lock-red-alt-2.svg/9px-Lock-red-alt-2.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration{color:#555}.mw-parser-output .cs1-subscription span,.mw-parser-output .cs1-registration span{border-bottom:1px dotted;cursor:help}.mw-parser-output .cs1-ws-icon a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/4/4c/Wikisource-logo.svg/12px-Wikisource-logo.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output code.cs1-code{color:inherit;background:inherit;border:inherit;padding:inherit}.mw-parser-output .cs1-hidden-error{display:none;font-size:100%}.mw-parser-output .cs1-visible-error{font-size:100%}.mw-parser-output .cs1-maint{display:none;color:#33aa33;margin-left:0.3em}.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration,.mw-parser-output .cs1-format{font-size:95%}.mw-parser-output .cs1-kern-left,.mw-parser-output .cs1-kern-wl-left{padding-left:0.2em}.mw-parser-output .cs1-kern-right,.mw-parser-output .cs1-kern-wl-right{padding-right:0.2em}
NCID BN00705318。
外部リンク
国際化学物質安全性カード スルファミン酸 日本語版 - 国立医薬品食品衛生研究所 (英語版)
| ||||||||





![{displaystyle {ce {{(NH2)HSO3}+H2O->[80,^{circ }{text{C}}]{NH4HSO4}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/97c1c3ec295e333e32172ea54946eee6bac0ab9c)