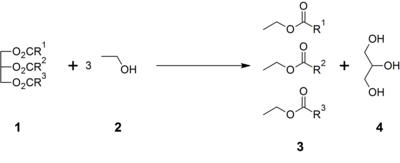グリセリン
| グリセリン | |
|---|---|
 | |
 | |
 | |
IUPAC名 propane-1,2,3-triol | |
別称 グリセリン グリセロール 1,2,3-プロパントリオール 1,2,3-トリヒドロキシプロパン グリセリトール グリシルアルコール | |
| 識別情報 | |
CAS登録番号 | 56-81-5 |
PubChem | 753 |
ChemSpider | 733 |
UNII | PDC6A3C0OX |
E番号 | E422 (増粘剤、安定剤、乳化剤) |
KEGG | C00116 |
ChEMBL | CHEMBL692 |
ATC分類 | A06,A06AX01 (WHO), QA16QA03 (WHO) |
SMILES
| |
InChI
| |
| 特性 | |
化学式 | C3H8O3 |
モル質量 | 92.09382 g/mol |
示性式 | C3H5(OH)3 |
| 外観 | 無色透明の液体 吸湿性 |
匂い | 無臭 |
密度 | 1.261 g/cm3 |
融点 | 17.8 °C, 291 K, 64 °F |
沸点 | 290 °C, 563 K, 554 °F ([2]) |
屈折率 (nD) | 1.4746 |
粘度 | 1.412 Pa·s[1] |
| 危険性 | |
安全データシート(外部リンク) | JT Baker |
NFPA 704 |  1 1 0 |
引火点 | 160 °C (密閉式) 176 °C (開放式) |
発火点 | 370 °C |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
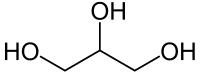
グリセリン (glycerine, glycerin) は、3価のアルコールである。学術分野では20世紀以降グリセロール (glycerol) と呼ぶようになったが、医薬品としての名称を含め日常的にはいまだにグリセリンと呼ぶことが多い。食品添加物として、甘味料、保存料、保湿剤、増粘安定剤などの用途がある。虫歯の原因となりにくい。医薬品や化粧品には、保湿剤・潤滑剤として使われている。
目次
1 性質
2 生産
2.1 油脂から
2.2 プロピレンから
3 生合成と代謝
4 刺激性
5 利用
6 反応
7 危険有害性と法規制
8 歴史
9 結晶化に纏わる都市伝説
10 出典
11 関連項目
12 外部リンク
性質
無色透明の糖蜜状液体で、甘味を持つ。
融点は約18°Cだが、非常に過冷却になりやすいため結晶化は難しい。冷却を続けると-100°C前後でガラス状態となり[3]、さらに液化した空気で冷却後、1日以上の時間をかけて緩やかに温度を上げると結晶化する[4]。
水に非常に溶けやすく、吸湿性が強い。水溶液は凝固点降下により凍結しにくく、共晶点は66.7重量%で-46.5°Cである。ほかにエタノール、フェノール、ピリジンなど様々な溶媒に可溶であるが、アセトン、ジエチルエーテル、ジオキサンには溶けにくく、ミネラルオイルやクロロホルムのような無極性溶媒には溶けない。[3]
生産
グリセロールは年間100万トン以上生産されている。そのほとんどが大豆油や獣脂などの加水分解によっているが、プロピレンから化学合成することもできる。現在試みられることはないが、発酵法も知られている[3]。
油脂から
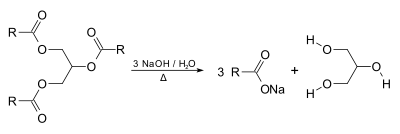
生物の油脂には大量のトリアシルグリセロール(トリグリセリド)が含まれている。これは脂肪酸とグリセリンのエステルであり、加水分解によりグリセリンと脂肪酸を生じる。例えば石鹸を生産する際に副産物として大量のグリセリンが得られる。
またバイオディーゼル燃料の主成分は脂肪酸メチルエステルであるが、これは触媒を用いた油脂とメタノールのエステル交換反応により得られ、その副産物がグリセリンである。
こうして得られたグリセリンには不純物が多く含まれている。石鹸生産の副産物の場合、活性炭や、アルカリ処理、イオン交換などによって精製を行い、蒸留によって高純度のグリセリンを得ることができる[3]。バイオディーゼル燃料生産の副産物の場合は不純物が非常に多い場合があり、単に焼却されることが多い[5]。
プロピレンから
プロピレンからエピクロロヒドリンを経由して合成するのが主であるが、ほかにもアクロレインや酸化プロピレンを経由する方法などが知られている。もっともバイオディーゼル燃料の普及にともないグリセリンは供給過剰になっており、こうした化学合成法はコスト的に見合わなくなっている。
生合成と代謝
グリセロールは生体内では中性脂肪、リン脂質、糖脂質などの骨格として存在しており、貯蔵した脂肪からエネルギーをつくる際に脂肪酸とグリセロールに分解される。生じたグリセロールはATPによって活性化されグリセロール3-リン酸となって再度脂質の合成に使われるか、さらにジヒドロキシアセトンリン酸を経て解糖系または糖新生に利用される。
アルコール発酵ではアセトアルデヒドが電子受容体となりエタノールが蓄積するが、このときジヒドロキシアセトンリン酸が電子受容体として働くとグリセロール3-リン酸が生じ、ついでグリセロールが生成する(グリセロール発酵)。たとえば培地がアルカリ性であったり、亜硫酸ナトリウムが添加されていたりすると、アセトアルデヒドが電子受容体として働くことができずグリセロール発酵が優勢となる。
刺激性
一般にアレルギーはまれとされ、比較試験ではグリセリンは偽薬として用いられ、グリセリンによるアレルギーの論文検索では4件の症例報告があり、うち2件では化粧品に配合された濃度の低い状態である[6]。喘息既往歴の人を除いた大学生262人にグリセリンのパッチテストを行い、スギなどのアレルゲンより小さいものの約半数に紅斑や膨湿が生じた[7]。
利用
化学原料としては、爆薬の成分や狭心症の薬となるニトログリセリンの原料として有名であるほか、有機合成でつかうヨウ化アリルの原料である。
- 食品添加物
甘味料、保存料、保湿剤、増粘安定剤などの用途がある。甘味料としては虫歯の原因となりにくいことや、エリスリトールやキシリトールが持つ清涼感を打ち消す効果がある。砂糖より甘さが弱いにもかかわらず高カロリーである。
- 医薬品など
医薬品、化粧品には、保湿剤・潤滑剤として使われている。浣腸、咳止めシロップ、うがい薬、練り歯磨き、石けん、ローションなど幅広い製品に利用されている。チンキの溶剤として、あるいは降圧剤としても使われている。
- 機械工業など
エチレングリコールやプロピレングリコールと同様に、不凍液を作るのに使われる。自動車用としてはより低温まで凍結しないエチレングリコールに取って代わられたが、安全面から再評価する意見もある[8]。実験室では、凍結保護剤として生物の凍結保存や、酵素の低温保存に用いられている。
機械式圧力計では、ケーシングの内部空間にグリセリン水溶液を充填した製品が存在する。これはグリセリンの粘性抵抗によって機械的振動を抑制して、ギアや指針といった可動部が摩耗・破損することを防ぐためである。
反応
ギ酸と加熱するとエステル化を経て脱離が起こり、アリルアルコールを与える[9]。硫酸水素カリウムなどを作用させながら熱すると、脱水が起こりアクロレインに変わる[10]。酸触媒の存在下にアセトンと加熱すると、脱水して1,2位がイソプロピリデン基で保護された形の誘導体が得られる[11]。
赤リンと臭素とともに反応させると1,3位が臭素化された誘導体が得られ[12]、酢酸中で塩化水素を作用させると、その当量により 1-モノクロロ体[13]もしくは1,3-ジクロロ体[14]が生成する。後者や 1,3-ジブロモ体をアルカリと加熱することにより、エピクロロヒドリン[15][16]、エピブロモヒドリン[16]が得られる。
アニリン誘導体と酸化条件で縮合させるとキノリン骨格が構築できる[17][18]。この手法はスクラウプのキノリン合成と呼ばれる。
危険有害性と法規制
摂取しても特段大きな害はないが、皮膚や粘膜に対して軽い刺激性がある。
可燃性の液体で、日本では消防法により危険物第4類(引火性液体)の第3石油類に指定されている。
歴史
1779年にスウェーデンのカール・ヴィルヘルム・シェーレがオリーブ油加水分解物の中から発見[3]。1813年ミシェル=ウジェーヌ・シュヴルールが油脂が脂肪酸とグリセリンのエステルであることを見出し、甘味を持つことからギリシャ語のγλυκυς(glykys、甘い)にちなんでglycérineと命名[3]。1846年にアスカニオ・ソブレロによりニトログリセリンが発見され、1866年にアルフレッド・ノーベルが実用化に成功[3]。1872年シャルル・フリーデルが、イソプロピルアルコールからの合成に成功し、グリセロールという名を提案。
結晶化に纏わる都市伝説
生物学者ライアル・ワトソンの1979年の著書『Lifetide』(邦題『生命潮流』)にて書かれていた事実無根の逸話が、様々な引用・脚色を経て、同じくワトソンによって創作された「百匹目の猿現象」と共にシンクロニシティの代表的伝説となっている。
ワトソンによる逸話は以下のとおり[19]。
- グリセリンの発見から100年以上、どのようにしてもグリセリンの結晶化は起こらなかった。
- 20世紀初頭のある日、ウィーンからロンドンに運ばれる途中の一樽のグリセリンが偶然に結晶化した。
- この樽から小分けしたグリセリンを受け取った化学者の試料は18°Cで固体になった。
- 熱力学に詳しいある二人の科学者もこのグリセリンを受け取って結晶化に成功すると、実験室の全グリセリンが密閉容器内のものを含めて自然に結晶化した。
- その後、グリセリンの結晶化は世界各地でありふれたものとなった。
しかし『生命潮流』で参考文献とされていた、カリフォルニア大のギブソンとジオークが書いた論文(1923年)には、グリセリン結晶を作る際のコツが記述されているのみである[4][20]。
- グリセリンは世界中の科学者がどのようにしても結晶化しなかった。
- ギブソンとジオークも、イギリスの偶然結晶化したグリセリンを入手した。
- グリセリン結晶が到着した後であったが、ギブソンとジオークは温度管理をすることで種結晶なしでも結晶を作ることができるということを発見した。
- グリセリンを -193 °C に冷却後、一日以上の時間をかけてゆっくりと温度を上げ、17.8 °C にすることで結晶化する。
要するに元来グリセリンは、種結晶がなくとも、上記の温度管理手順に従えば結晶化できるのである。なお、グリセリンではなくニトログリセリンにおいてこのような逸話が語られることもあるが、ニトログリセリンの場合は8°Cで凍結し、14°Cで融けるため無論事実ではない。(ニトログリセリン参照)
出典
^ “Viscosity of Glycerol and its Aqueous Solutions”. 2011年4月19日閲覧。
^ Lide, D. R., Ed. CRC Handbook of Data on Organic Compounds, 3rd ed.; CRC Press: Boca Raton, FL, 1994; p 4386.
- ^ abcdefgChristoph, Ralf; Schmidt, Bernd; Steinberner, Udo; Dilla, Wolfgang; Karinen, Reetta (2006). “Glycerol”. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a12_477.pub2. ISBN 3527306730.
- ^ abG. E. Gibson , W. F. Giauque (1923). “The third law of thermodynamics. Evidence from the specific heats of glycerol that the entropy of a glass exceeds that of a crystal at the absolute zero”. J. Am. Chem. Soc. 45 (1): 93-104. doi:10.1021/ja01654a014.
^ Sims, Bryan (2011年10月25日). “Clearing the Way for Byproduct Quality: Why quality for glycerin is just as important for biodiesel”. Biodiesel Magazine. http://www.biodieselmagazine.com/articles/8137/clearing-the-way-for-byproduct-quality
^ Suzuki R, Fukuyama K, Miyazaki Y, Namiki T (March 2016). “Contact urticaria syndrome and protein contact dermatitis caused by glycerin enema”. JAAD Case Rep (2): 108–10. doi:10.1016/j.jdcr.2015.12.011. PMID 27051845. https://www.ncbi.nlm.nih.gov/pmc/articles/pmid/27051845/.
^ 島田均、吉田博一、田中晃、佐藤成彦、清水宏明、森朗子、馬場廣太郎「586 皮内反応におけるグリセリンの影響について : 獨協医大BST学生での皮内テスト調査結果から」、『アレルギー』第44巻第8号、1995年、 1045頁、 doi:10.15036/arerugi.44.1045_2、 NAID 110002424545。
^ Hudgens, R. Douglas; Hercamp, Richard D.; Francis, Jaime; Nyman, Dan A.; Bartoli, Yolanda (2007). An Evaluation of Glycerin (Glycerol) as a Heavy Duty Engine Antifreeze/Coolant Base. doi:10.4271/2007-01-4000.
^ Kamm, O; Marvel, C. S. (1921). “Allyl alcohol”. Organic Syntheses 1: 15. http://www.orgsyn.org/demo.aspx?prep=cv1p0042. ; Collective Volume, 1, pp. 42
^ Adkins, H.; Hartung, W. H. (1926). “Acrolein”. Organic Syntheses 6: 1. http://www.orgsyn.org/demo.aspx?prep=cv1p0015. ; Collective Volume, 1, pp. 15
^ Renoll, M.; Newman, M. S. (1948). “dl-Isopropylideneglycerol”. Organic Syntheses 28: 73. http://www.orgsyn.org/demo.aspx?prep=cv3p0502. ; Collective Volume, 3, pp. 502
^ Braun, G (1934). “Glycerol α,γ-dibromohydrin”. Organic Syntheses 14: 42. http://www.orgsyn.org/demo.aspx?prep=cv2p0308. ; Collective Volume, 2, pp. 308
^ Conant, J. B.; Quayle, O. R. (1922). “Glycerol α-monochlorohydrin”. Organic Syntheses 2: 33. http://www.orgsyn.org/demo.aspx?prep=cv1p0294. ; Collective Volume, 1, pp. 294
^ Conant, J. B.; Quayle, O. R. (1922). “Glycerol α,γ-dichlorohydrin”. Organic Syntheses 2: 29. http://www.orgsyn.org/demo.aspx?prep=cv1p0292. ; Collective Volume, 1, pp. 292
^ Clarke, H. T.; Hartman, W. W. (1923). “Epichlorohydrin”. Organic Syntheses 3: 47. http://www.orgsyn.org/demo.aspx?prep=cv1p0292. ; Collective Volume, 1, pp. 233
- ^ abBraun, G. (1936). “Epichlorohydrin and epibromohydrin”. Organic Syntheses 16: 30. http://www.orgsyn.org/demo.aspx?prep=cv2p025. ; Collective Volume, 2, pp. 256
^ Clarke, H. T.; Davis, A. W. (1922). “Quinoline”. Organic Syntheses 2: 79. http://www.orgsyn.org/demo.aspx?prep=cv1p0478. ; Collective Volume, 1, pp. 478
^ Mosher, H. S.; Yanko, W. H.; Whitmore, F. C. (1947). “6-Methoxy-8-nitroquinoline”. Organic Syntheses 27: 48. http://www.orgsyn.org/demo.aspx?prep=cv3p0568. ; Collective Volume, 3, pp. 568
^ ライアル・ワトソン『生命潮流―来たるべきものの予感』(工作舎、1981年)37刷pp.59-60
^ 菊池誠 (2005年5月21日). “グリセリンの結晶”. kikulog. 2010年8月24日閲覧。
関連項目
立体特異的番号付け - グリセロールの誘導体に対する命名規則
外部リンク
- Glycerolグリセリン